

|
CONSENSUS CONFERENCE SULL’IPOTERMIA PERIOPERATORIA |
| Montanini S. §, Martinelli G. §^, Torri G. §§^, Pattono R. §§*, Borzomati E. §§**, Proietti R. §§^^, Baroncini S. §§§^, ,Bertini L. §§§§, Berti M. §§^ |
| § Istituto di Anestesia e Rianimazione, Università di Messina |
| §^ Istituto di Anestesia e Rianimazione, Università di Bologna |
| §§^ Dipartimento of Anestesia, Università di Milano, IRCCS H. San Raffaele, Milano |
| §§* Istituto di Anestesia e Rianimazione, Università di Torino |
| §§** Istituto di Anestesia e Rianimazione, Università La Sapienza, Roma |
| §§^^ Istituto di Anestesiologia e Rianimazione, Universita Cattolica del Sacro Cuore ,Roma |
| §§§^ Unità Operativa "Baroncini" Policlinico S.Orsola Malpighi-Bologna |
| §§§§ Dipartimento d'anestesia Centro Traumatologico Ortopedico, Roma |
L’ipotermia lieve, temperatura centrale compresa tra a 36 e 33°C, è un evento comune durante l’anestesia sia essa generale che locoregionale che integrata.
L’ipotermia accidentale, se pur lieve, determina importanti alterazioni a carico del sistema cardiovascolare, del sistema endocrino e metabolico, della crasi ematica, che rendono ragione della aumento di morbilità e mortalità che si rileva nei pazienti ipotermici rispetto ai pazienti mantenuti in condizioni di normotermia. L’ipotermia accidentale lieve deve quindi essere evitata. A questo scopo è necessario conoscere i diversi aspetti fisiopatologici della termoregolazione, oltre che i sistemi di misurazione della Tc e quelli per il riscaldamento del paziente.
Scopo di questa Consensus Conference è quello di stabilire delle raccomandazioni per prevenire e/o trattare l’ipotermia accidentale perioperatoria sia nell’adulto che nel bambino
Summary
Mild hypothermia is a common event during general, regional or integrated anesthesia. Unintentional mild hypothermia Core temperature 36 °C<cT>33 °C, may promotes cardiovascular, hematological, metabolic and hormonal derangement that may explain greater mortality and morbidity in hypothermic patients than in normothermic ones. For these reasons unintentional mild hypothermia may be avoid. Its necessary to know thermoregulation system, and its physiology, the temperature monitor devices and how to prevent or to reduces the decrease of cT during anesthesia. The aim of this Consensus Conference is to give recommendation to prevent and to care unintentional perioperative hypothermia in adult and in children.
Il valore clinico della temperatura fu scoperto da Santorio nel 1646, ma solo due secoli dopo, con Wunderlich, la temperatura corporea acquistò il significato di parametro vitale. Fino a metà degli anni 60 il monitoraggio della temperatura corporea non veniva praticato routinariamente in anestesia, finché non furono osservati i primi casi di ipertermia maligna. Si noto’ infatti che una diagnosi precoce del rialzo della temperatura corporea consentiva di ridurre dall’80% al 30%la mortalità correlata con tale sindrome. Tuttavia, è noto da tempo che l’effetto più frequentemente indotto dall’anestesia sul corpo umano non è l’ipertermia, bensì l’ipotermia, se, come scrive Pickering nel 1956, "Il più valido sistema per raffreddare un uomo è sottoporlo ad anestesia". A tutt’oggi, però, pur essendo l’anestesista a conoscenza degli effetti negativi indotti dall’anestesia sulla termoregolazione umana, la temperatura corporea non viene monitorizzata, se non in pochi casi selezionati, né vengono adottati provvedimenti per ridurre le alterazioni della temperatura centrale nel periodo perioperatorio. La mancanza di sensibilità nei confronti del problema "termoregolazione ed anestesia" non è però legato all’assenza di ricerche cliniche rilevanti sull’argomento, bensì allo scarso interesse da parte dei medici anestesisti ed alle ridotte risorse economiche messe a disposizione dalle Aziende Sanitarie. Tale problema, tuttavia, non riguarda solo la comunità anestesiologica Italiana. Infatti anche se la Basic American Society of Anesthesiologist Monitoring Standards raccomanda il monitoraggio della temperatura corporea in tutti i pazienti alla stregua di saturimetria, capnometria, pressione arteriosa e frequenza cardiaca, non esistono allo stato attuale precise linee guida emanate dall’American Society of Anesthesiologists né sul controllo della termoregolazione né sui sistemi da adottare per prevenire l’ipotermia (1). L’obiettivo di questa Consensus Conference è quello di ricavare dalla abbondante letteratura presente sull’argomento alcune raccomandazioni più precise inerenti la gestione anestesiologica dell’omeostasi termica perioperatoria.
1.1. CHE COSA SONO LA NORMOTERMIA E L’IPOTERMIA LIEVE?
Curley definisce come normotermia una temperatura centrale (Tc) compresa tra 36,6 ±
0,38°C (2). Blight e Johnson definiscono lo stato di ipotermia come la Tc di un animale omeotermo al di sotto di una deviazione standard rispetto alla temperatura media della specie (3).
In anestesia è frequente la comparsa di una ipotermia definita come lieve, cioè un valore di temperatura centrale compresa tra 36°-33°C. Al di sotto dei 36°C si instaurano alterazioni del metabolismo dei farmaci, del sistema coagulativo, della ossigenazione dei tessuti, oltre che alcune delle reazioni atte a limitare la dispersione termica da parte dell’organismo (4)(5).
1.2. DIMENSIONE DEL PROBLEMA "IPOTERMIA" IN ANESTESIA
Il 50% dei pazienti operati presenta a fine intervento valori di Tc < 36°, ed il 33% di questi sviluppa gradi maggiori di ipotermia, con Tc < 35°C (6).
1.3
COME È REGOLATA LA TEMPERATURA CORPOREA
I segnali termici captati da appositi recettori posti nella cute, negli organi addominali, toracici, e nel midollo spinale vengono trasportati al centro termoregolatore ipotalamico da fibre nervose non mieliniche, le fibre C. A questo livello gli impulsi sono integrati e confrontati con un valore prestabilito corrispondente all’incirca a 37 °C, il "set point". Per valori integrati vicini al valore di set point (±
0,2°C) non si sviluppa nessuna reazione termoregolatoria. Questo intervallo è detto range intersogliare. Se il valore integrato è al di sotto o al di sopra del set point ed oltre il range intersogliare s’innescano reazioni termoregolatorie comportamentali (vestirsi o spogliarsi, etc.), ed autonomiche (vasocostrizione, termogenesi senza brivido, brivido, vasodilatazione, sudorazione, etc.) atte a minimizzare l’alterazione termica. Deve essere sottolineato che non è la sola temperatura centrale ad essere regolata quanto piuttosto la temperatura corporea media:
| Temperatura corporea media = (0, 85 x Tc) + (0,15 x Tcute) |
|
Tc= temperatura centrale T cute= 0,3 (T torace+T braccio)+ 0,2 (T coscia+ Tgamba) (7)(8)(9) |
Dal punto di vista termofisiologico possiamo distinguere nel corpo umano una parte più calda, il cosiddetto core, omeoterma con temperatura di 37°C, una periferica più fredda 33-34°C e una detta shell o compartimento cutaneo con temperatura di 28-32°C. La prima, in cui qui la temperatura rimane costante, è costituita da cervello, organi mediastinici ed addominali (50-60% della massa corporea); la seconda è costituita sostanzialmente da arti superiori ed inferiori (45% della massa corporea) e funge da tampone nei confronti delle variazioni termiche grazie ai fenomeni di vasocostrizione e dilatazione che in essa avvengono. Infine il compartimento cutaneo che ha azione di filtro tra i due precedenti e l’ambiente esterno. Tra compartimento centrale e periferico, esiste un gradiente di temperatura di 2-4 °C determinato dalla vasocostrizione del circolo periferico imposta da stimoli tonici ortosimpatici provenienti dall’ipotalamo, dove è localizzato il centro termoregolatore.
1.4 COME AGISCE L'ANESTESIA SULLA TERMOREGOLAZIONE?
In condizioni normali l’uomo regola la propria temperatura corporea mantenendo in equilibrio la produzione e la dispersione di calore. In ambiente termofisiologicamente neutro (28°C), la produzione di calore a riposo avviene grazie al metabolismo degli alimenti. Durante il movimento il 90% del calore è prodotto invece dalle masse muscolari: un aumento della produzione di calore può quindi avvenire per aumento del metabolismo basale o per aumento dell’attività muscolare. Espressa in Watt la produzione di calore a riposo, risultato del metabolismo ossidativo dei substrati nutritivi, è dell’ordine di 100 Watt, che corrispondono a circa 2000 Kcal. La termogenesi può essere espressa anche in termini di consumo di ossigeno (VO2) a partire dall’equivalente calorico dell’ossigeno: ad un VO2 di 300 ml/min corrisponde una produzione di calore 100 Watt (7). La dispersione di calore avviene grazie alla presenza di un gradiente termico esistente tra corpo ed ambiente esterno, attraverso i fenomeni di evaporazione, conduzione, convezione ed irradiazione (8)(9).
1.4.A Anestesia generale
L’anestesia generale, sia inalatoria che endovenosa, determina una alterazione del centro termoregolatore ipotalamico, con notevole aumento del range intersogliare (da 0,2 a 4°C) (10). Ciò in pratica si traduce nella mancata risposta termoregolatoria dell’organismo fino a Tc notevolmente più alte o più basse del fisiologico valore di riferimento. All’induzione dell’anestesia generale si nota il calo maggiore della Tc: la riduzione del fisiologico valore di soglia per la vasocostrizione, determina una diminuzione della scarica tonica ortosimpatica sul sistema arteriolare con
redistribuzione del calore dal centro, più caldo, verso la periferia, più fredda. In pratica la temperatura centrale scende e quella periferica sale seguendo il gradiente termico preimposto dall’ipotalamo. Dopo questa fase iniziale la Tc continua a diminuire per i fenomeni di dispersione termica ambientale (convezione, irradiazione, evaporazione e conduzione) fino verso la terza o quarta ora di anestesia. A questo punto la Tc si stabilizza (fase di plateau): si crea cioè un equilibrio dinamico tra produzione e perdita di calore. In generale possiamo dire che dopo tre o quattro ore di anestesia si raggiunge una perdita di Tc di 2,8 ±
0,5°C (11)(12).
1.4.B Anestesia loco-regionale
I blocchi centrali, subaracnoidei ed epidurali, provocano una riduzione della temperatura centrale simile nei valori e nel trend a quelli prodotti dall’anestesia generale, ma di durata maggiore. L’ipotermia, infatti, persiste quasi fino alla risoluzione del blocco anestetico (13). L’anestesia condotta mediante blocchi centrali determina ipotermia sia per azione a livello centrale, sull’ipotalamo, sia per azione a livello periferico, sul sistema ortosimpatico. Il blocco delle fibre del sistema nervoso autonomo comprese nel territorio sottoposto a blocco anestetico, determina una
redistribuzione del calore dal centro verso la periferia per inibizione della scarica tonica ortosismpatica. Il meccanismo alla base della alterazione del centro ipotalamico è singolare: normalmente con una temperatura dei tessuti periferici di 33 °C i termocettori fornirebbero una scarica tonica sull’ipotalamo che sarebbe persa con l’instaurarsi del blocco anestetico. Il centro termoregolatore interpreterebbe la mancanza di questi impulsi tonici come riscaldamento relativo, tollerando temperature centrali più basse della norma prima di dare origine a risposte termoregolatrici. Anche in anestesia loco-regionale, così come in anestesia generale, la causa più importante di riduzione della Tc è rappresentata dalla
redistribuzione del calore dal centro verso la periferia. In questo caso però la
redistribuzione ha una causa fondamentalmente periferica (il blocco dei nervi che scaricano tonicamente sugli shunt arterovenosi) che, anche se limitata alla parte inferiore del corpo, è in grado di determinare un raffreddamento rilevante. Dopo due ore d’anestesia la temperatura centrale può ridursi di circa 2°C rispetto al valore basale. Il trend della temperatura centrale è, anche in questo caso, una curva trifasica, con maggior pendenza nella prima fase, quella della
redistribuzione, una più lento abbassamento nella seconda fase, ed infine una fase di plateau. Si raggiunge cioè un equilibrio dinamico tra dispersione di calore, che si riduce per effetto della vasocostrizione nella parte di superficie corporea non compresa nel blocco, e della produzione di calore, che aumenta per effetto del brivido (14)(15)
1.4.C L’anestesia integrata
L’anestesia generale leggera associata ad un blocco centrale continuo, determina gradi veramente elevati d’ipotermia. Questo perché gli effetti delle due tecniche vengono a potenziandosi. La soglia di vasocostrizione con questo tipo di anestesia è di circa 1 °C più bassa di quella presente durante anestesia generale. L’effetto sinergico dell’anestesia loco-regionale e generale sui centri termoregolatori e sugli organi effettori, determina un rapido e progressivo raffreddamento. Il blocco epidurale continuo intraoperatorio non consente la vasocostrizione agli arti inferiori e ciò determina la mancanza del plateau. In questi pazienti é particolarmente difficile mantenere uno stato di normotermia (16)(17)(18).
1.4.D Il tourniquet emostatico
Quando il tourniquet viene applicato agli arti rende impossibile lo scambio di calore tra questi ed il core; nell’adulto riduce la caduta termica iniziale o consente un precoce raggiungimento del plateau. Tuttavia i tessuti a valle del toruniquet divengono veramente ipotermici e quando il tourniquet viene sgonfiato si verifica una precipitosa
redistribuzione del calore con conseguente ipotermia (19).
1.5. L’IPOTERMIA LIEVE PERIOPERATORIA DEVE ESSERE CONTRASTATA E PERCHÉ
Un grado lieve d’ipotermia controllata, può essere d’aiuto in alcune particolari specialità chirurgiche, neurochirurgia, cardiochirurgia e chirurgia vascolare, o quando si voglia di proteggere i tessuti dal danno ischemico (18)(20). Tuttavia, l’ipotermia accidentale è sempre dannosa, comportando complicanze sia intra che postoperatorie. Nel periodo intraoperatorio all'ipotermia si accompagnano una diminuzione della clearance dei farmaci anestetici e dei curari, così come un’alterazione della coagulazione e della crasi ematica (21). Per ogni grado perso di temperatura corporea l’ematocrito sale di circa 1-2 punti percentuali (22)(23). Nel periodo postoperatorio l’ipotermia contribuisce ad aumentare l’incidenza di desaturazione e di accidenti ischemici miocardici (24)(25). Quest’ultima complicanza può essere attribuita all’aumento della concentrazione plasmatica di noradrenalina, che quadruplica per riduzione della Tc di 0,7°C, adrenalina e cortisolo (26). I pazienti ipotermici, inoltre, presentano una maggiore incidenza di infezioni delle ferite chirurgiche, attribuibile all’aumento della concentrazione plasmatica di cortisolo ed alla ridotta produzione di fattori ad effetto proinfammatorio . Infine, la riduzione della temperatura centrale comporta allungamento dei tempi di risveglio dall’anestesia generale e di dimissione dalla recovery room oltre che gradi maggiori di discomfort e di dolore postoperatorio(27).
1.6 IL BRIVIDO POSTOPERATORIO DEVE ESSERE CONTRASTATO?
Il ritorno allo stato di normotermia è possibile grazie ad una riduzione della termodispersione con concomitante aumento della produzione di calore. Il recupero del calore perso durante l’anestesia generale avviene molto lentamente circa 0,5°C/h. In pazienti sottoposti ad anestesia subaracnoidea o epidurale continua il recupero termico è ancora più lento. Infatti, i pazienti con un blocco centrale in corso, oltre ad avere una ridotta risposta ormonale con scarso aumento del metabolismo ossidativo, manifestano brivido con Tc più bassa ed hanno minori masse muscolari reclutabili per aumentare la produzione di calore per effetto del blocco stesso (28)(29). Il brivido compare in circa il 50% dei pazienti con temperatura centrale pari a 35,5 e nel 90% dei pazienti con Tc pari a 34,5°C. Va aggiunto che solo una piccola percentuale dei pazienti normotermici presenta brivido (brivido non termoregolatorio o disinibitorio da coda anestesiologica). Nei pazienti ipotermici lo studio del pattern elettromiografico dimostra che il brivido è termoregolatorio, si verifica come reazione allo stato di ipotermia e determina un notevole aumento del VO2 (fino a 50-100% del basale). Se ci si limita a combatterlo con la sola terapia farmacologica il recupero di calore sarà ancora più lento, ed il paziente verrà privato di un importante meccanismo di difesa contro la riduzione della Tc (30)(31). Il brivido quindi deve essere prima di tutto prevenuto, impedendo l’instaurarsi dell’ipotermia. Quando si presenti va combattuto principalmente riscaldando il paziente e successivamente somministrando farmaci che lo inibiscano (32)
1.7. SISTEMI DA ADOTTARE PER PREVENIRE L’IPOTERMIA PERIOPERATORIA
L’ipotermia può essere prevenuta conoscendo i fattori di rischio del paziente e l’efficacia dei sistemi di riscaldamento (33).
1.7.A Età
I soggetti anziani tendono a sviluppare gradi elevati di ipotermia sia in anestesia generale che locoregionale (blocchi centrali) (34)(35). Questo fatto è da attribuire a diversi fattori, quali la fisiologica riduzione del metabolismo basale, l’alterazione del centro termoregolatore, e la diminuzione delle masse muscolari. La soglia di vasocostrizione nel soggetto di oltre 60 anni sottoposto ad anestesia è di 1,2°C più bassa rispetto a quella di pazienti più giovani, così come la soglia del brivido dopo anestesia intrarachidea è di circa 1°C più bassa nel soggetto che ha oltrepassato gli 80 anni. Il neonato ed il bambino, per l’elevato rapporto tra superficie e massa corporea, perdono facilmente calore: la temperatura centrale può abbassarsi non solo durante l’intervento ma anche nella fase di risveglio.
1.7.B Costituzione fisica
Negli individui obesi la redistribuzione iniziale determina una caduta della Tc minore che negli adulti normali almeno nella prima ora d’anestesia (35)
1.7.C La temperatura ambientale
E’ il fattore critico per lo sviluppo dell’ipotermia, soprattutto in età estreme. I soggetti a maggior rischio d’ipotermia beneficiano di una temperatura ambiente mantenuta tra 21-e 24 gradi centigradi, con un tasso d’umidità relativa del 40-60%(36)(37)(38). La perdita di calore attraverso la cute per temperature di sala di 24°C è pari a 70 Watt, e le perdite aumentano di circa 10 Watt per ogni grado di temperatura ambientale inferiore a 24°C.
1.7.D Ventilazione
Per riscaldare ed umidificare le miscele gassose erogate durante la ventilazione meccanica viene perso il 6,6-8,1% (0,06 °C/h ) della produzione totale di calore. La ventilazione con circuito rotatorio e canestro di calce sodata minimizza il fenomeno ipotermia per la rirespirazione di gas già riscaldati ed umidificati. Il sistema risulta più efficiente se si utilizzano flussi di gas freschi inferiori a 3 l/min e se si adottano filtri umidificatori (39) (40)
1.7.E Infusioni
La somministrazione di fluidi riscaldati a 37°C, può contribuire a ridurre l’incidenza di ipotermia. Con un calcolo matematico è possibile prevedere la caduta della temperatura per l’infusione di fluidi:
| (Cfl x Mfl )/ (Cpt x Mpt)=(Tend-Tstart)/(Tfl -Tend) |
|
Cfl = calore specifico del fluido (1 cal/gm C°) Mfl= massa di fluido infusa Cpt= calore specifico del paziente (0,83 cal/gm°C) Mpt= massa del paziente Tstart= temperatura del paziente all’inizio Tend=temperatura del paziente alla fine dell’infusione Tfl=temperatura del fluido infuso |
Se, per ipotesi, ad un bambino di tre chili fossero infusi 300 ml di soluzione salina a 23°C in tre ore, alla fine dell’intervento questi avrebbe perso circa 1,5°C solo per l’infusione di fluidi. Questa perdita comporta un debito di circa 1200 Kcal, che dovrà essere ripagata in aumento del VO2 alla fine dell’intervento (termogenesi senza brivido). Se la stessa quota di fluidi fosse infusa a 32-33°C la perdita di calore sarebbe di solo 400 Kcal con una caduta di temperatura di 0,5°C. In un paziente adulto l’infusione di una massa di fluidi pari a 300 ml a 23 gradi determina un diminuzione di soli 0,1°C. Per avere una perdita analoga a quella avuta nel bambino dell’esempio precedente occorrerebbe somministrare 7000 ml a 23°C.
La somministrazione di fluidi riscaldati a 38°C può annullare le perdite caloriche legate alle infusioni. I riscaldatori di fluidi in commercio possono essere di due tipi:
1) source heating, riscalda la sacca prima della trasfusione;
2) in line heating, riscalda la sacca durante la trasfusione (41). Tra questi ultimi si distinguono tre tipi riscaldatori:
A) a secco (resistenza che riscalda una piastra metallica in
cui è presente la bobina-deflussore):
B) riscaldatori a bagno (la bobina-deflussore passa
attraverso acqua riscaldata);
C) controcorrente (il fluido da infondere viaggia al centro
di un sistema coassiale dove passa, nella direzione opposta, dell’acqua
riscaldata).
Nel riscaldatore a bagno la temperatura del fluido che arriva al paziente dipende dalla velocità di infusione: per flussi bassi il liquido si raffredda prima di arrivare al paziente. Nei sistemi in line heating il riscaldamento del fluido dipende dal tempo di contatto con la resistenza e dalla distanza tra resistenza e paziente: Faries e coll. (42) hanno dimostrato che i fluidi riscaldati a 37,3°C, se somministrati ad una velocità di 100 ml ora, arrivano al paziente con una temperatura di 24°C se la distanza tra paziente e fonte di calore supera 105 cm. Il sistema di riscaldamento controcorrente appare come quello più efficiente nel riscaldamento delle infusioni (43). Solo con questo sistema la temperatura dei fluidi che arrivano al paziente è all’incirca quella impostata sul termostato.
1.7.F Sistemi di riscaldamento esterno passivi
Le copertine metalliche
Sono usate allo scopo di isolare il paziente e ridurre la dispersione termica per convezione ed irradiazione. Tuttavia la loro efficacia è scarsa. Per interventi di lunga durata che comportano esposizione di vaste superficie corporee, essi riescono solo a ridurre la dispersione termica del 30% oppure solo del 10% in più rispetto ai teli chirurgici (7).
1.7.G Sistemi di riscaldamento esterno attivo
I materassini ad acqua
Sono inefficaci per il mantenimento dell’omeotermia sia nell’adulto sia nei bambini con superficie corporea superiore a 0,5 m2 (all’incirca 10 Kg di peso e 14 mesi di età) (43). La superficie corporea che appoggia sul materasso infatti oltre ad essere limitata, 20%, presenta uno scarso flusso plasmatico, i vasi sanguigni infatti sono costretti dal peso del paziente, la possibilità di trasferire calore al core è quindi limitata; inoltre, la scarsa circolazione di sangue può favorire le ustioni. In pratica contro un teorico trasferimento di calore di 41 Watt/m2/°C di gradiente termico materasso/cute il guadagno netto è solo di 10 Watt. La resa non può essere migliorata poiché il materasso non deve essere riscaldato oltre i 41°C per il rischio di ustioni (7).
Sistemi forced air warming
I sistemi convettivi ad aria calda (Forced air warming) sono i più efficienti per il riscaldamento del paziente e la prevenzione dell’ipotermia periopertoria. Se si riscalda il paziente per 30 minuti prima dell’induzione dell’anestesia si può limitare la riduzione iniziale della Tc da
redistribuzione. Se il riscaldamento preoperatorio si protrae per altri 30 minuti il fenomeno può essere addirittura eliminato, poiché così facendo si annulla completamente il gradiente termico tra core e periferia (16)(44). I sistemi convettivi ad aria calda sono in grado di erogare circa 43 Watt/m2/°C di gradiente termico materasso/cute quando l’intera superficie corporea sia coperta (7). La loro efficienza è stata documentata anche quando la superficie disponibile per il riscaldamento sia ridotta o durante la fase di risveglio quando sia presente vasocostrizione (44)(45)(46)(47).

|

|
|
|
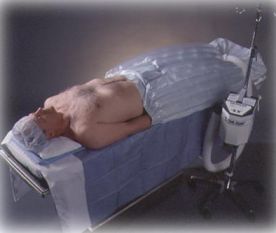
Fig.1.Materassini a circolazione di aria calda. A sinistra in basso il sistema di produzione dell'aria calda che viene collegato ai materassini con un tubo di grosso diametro. |
1.8. IL MONITORAGGIO: IN QUALE PAZIENTE E CON QUALI SONDE
La temperatura da monitorizzare è sempre quella centrale. Per temperatura centrale s’intende la temperatura del centro termoregolatore, cioè dell’ipotalamo. Esistono vari tipi di sonde che consentono la misurazione della Tc.
1.8.A Sonda nasofaringea
Monitorizza la temperatura del sangue che fluisce nelle branche dell’arteria carotide interna. La corretta profondità’ da raggiungere con tale sonda è uguale alla distanza fra narice e meato uditivo esterno. La temperatura registrata a livello faringeo è circa 0,2 ° C più bassa di quella esofagea (48).
1.8.B Sonda timpanica
Misura la temperatura del sangue che fluisce, in prossimità della membrana del timpano, dalla carotide esterna. I valori riportati dal monitoraggio timpanico della temperatura, quando la sonda sia ben posizionata, sono accurati come quelli ottenuti da sonde poste in arteria polmonare o in esofago. Un ridotto flusso plasmatico carotideo però potrebbe determinare misurazioni incongrue (48).
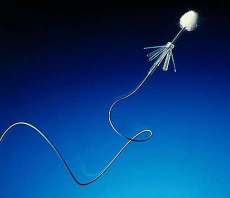 |
| Fig2. Sonda per la misurazione della temperatura timpanica |
1.8.C Sonda esofagea
Deve essere posta al quarto inferiore dell’esofago, davanti al cuore e lontana dalla carena tracheale. In genere a 38-42 cm di distanza dagli incisivi mediali. In questa posizione viene misurata la temperatura del sangue aortico. Le misurazioni effettuate attraverso questa metodica riflettono in maniera precisa le variazioni termiche ma possono essere poco accurate durante interventi a torace aperto o quando in esso siano infusi liquidi refrigeranti. Ovviamente questo sistema di monitoraggio è mal tollerato dai pazienti svegli (49)
1.8.D Sonda vescicale
Essendo l’urina un ultrafiltrato del sangue non sorprende che un termometro posizionato in vescica possa riflettere in maniera accurata le variazioni della temperatura corporea (41). La sonda termica è montata su di un catetere tipo Foley è quindi di facile posizionamento ed utile per il monitoraggio a lungo termine. Possono alterare le misurazioni l’oligoanuria, pelviperitoniti e lavaggi peritoneali .
 |
Fig3.Catetere vescicale che consente il monitoraggio della temperatura. A=Rilevatore della temperatura,B=Cavo di collegamento al monitor |
1.8.F Sonda rettale
E’ stata usata molto in passato; può fornire informazioni attendibili sulla temperatura centrale indipendentemente dalle condizioni di temperatura ambientale ma risponde poco rapidamente alle variazioni repentine di temperatura. Inoltre se la sonda è posizionata troppo in basso, verso lo sfintere anale, può risentire del sangue refluo dai glutei che ha notoriamente temperatura più bassa rispetto a quello di provenienza viscerale. La temperatura rettale non è affidabile quando si eseguano interventi chirurgici urologici, sulla pelvi o sul bacino.(50)
1.8.G Sonda in arteria polmonare
E’ sicuramente un metodo con sensibilità ed accuratezza adeguata ma invasivo e costoso. Può essere sostituita da quella esofagea o timpanica quando non indispensabile (50).
1.8.H Sonde cutanee
Sono utili e convenienti per misurare il trend della temperatura e l’eventuale presenza di vasocostrizione o variazioni del flusso calorico. La sonda ascellare comporta che il paziente tenga l’arto completamente addotto per prevenire il raffreddamento della sonda da parte dell’aria circostante. Può risentire (specialmente nel bambino) dei liquidi di infusione iniettati nell’arto omolaterale. I sensori a cristalli liquidi posti sulla fronte avvertono di cambiamenti della temperatura di 0,5 C. Nel caso di una lieve ipotermia o vasocostrizione della cute della fronte, i cristalli liquidi leggono una temperatura che è di circa 2-3 °C al di sotto della temperatura timpanica e sono perciò inaffidabili.
2 TERMOFISIOLOGIA IN ETÀ PEDIATRICA
Anche in età pediatrica il flusso di calore durante anestesia è governato dalle leggi della irradiazione, evaporazione, conduzione e convezione ma più che nell’adulto l’entità ed il contributo di questi fattori può dipendere dalla temperatura ambientale (51). La maggior parte del calore viene persa per irradiazione (trasferimento di calore tra due oggetti non in contatto tra loro e con diverse temperature) a causa dell’elevato rapporto superficie volume, che contraddistingue il bambino. La perdita di calore per conduzione, al contrario, riveste un ruolo di secondaria importanza durante l’anestesia. Mentre nell’adulto la dispersione termica per il riscaldamento e l’umidificazione dei gas freschi somministrati durante la ventilazione meccanica, è il 10% della dispersione totale di calore in anestesia, nel bambino può raggiungere il 25% del totale (51). La vasocostrizione e la vasodilatazione possono intervenire sia nel prematuro sia nel nato a termine con conseguente riduzione o aumento della perdita calorica per convezione e conduzione.
Il meccanismo più importante per la produzione di calore nel bambino è rappresentato dalla termogenesi senza brivido definibile come un aumento del calore metabolico senza aumento del lavoro muscolare (2). Avviene soprattutto nel grasso bruno ma anche nel fegato e nel cervello. Il grasso bruno è particolarmente ricco di mitocondri ed innervato dal sistema ortosimpatico. Il rilascio di noradrenalina consente un aumento della capacità ossidativa dei substrati. Verso i sei anni la termogenesi senza brivido viene sostituita dal brivido. Come sia regolato questo shift non è noto. La vasocostrizione e l’atteggiamento comportamentale sono invece sempre attivi (52).
2.2 Termoregolazione
I nati a termine presentano un centro termoregolatore intatto e ben funzionante in cui le risposte per il mantenimento dell’omeostasi termica (Tc 36-37,5) vengono attivate, come nell’adulto, sulla base della temperatura corporea media. L’anestesia inalatoria determina un aumento del range intersogliare per cui la risposta termoregolatoria inizia per Tc < 2,5°C al basale per l’ipotermia e Tc>1,3°C al basale per l’ipertermia.
2.3 Trend della curva termica in anestesia
In età pediatrica, come nell’adulto, si verifica una prima fase di calo della Tc per
redistribuzione, quindi una seconda fase di decremento lineare della Tc ed una terza fase di plateau. Nel piccolo paziente la terza fase interviene prima che nell’adulto per attivazione della termogenesi senza brivido. L’ipotermia, inoltre, provoca aumento del VO2 e della increzione di catecolamine e, ciò rende ragione di complicanze intraoperatorie come ipossia ed aumento delle resistenze vascolari polmonari. Nel periodo postoperatorio la riduzione della Tc può accompagnarsi ad aumentata incidenza di apnea oltre che alle altre complicanze viste prima per l’adulto (53).
2.4 Monitoraggio
Ci sono tre ragioni fondamentali nel monitoraggio della temperatura in età pediatrica: valutare il contenuto ed il flusso calorico, confermare la diagnosi di ipertermia maligna, prevenire alterazioni termiche iatrogene.
Il monitoraggio della temperatura dovrebbe riflettere la Tc. A questo scopo è possibile utilizzare diverse opzioni in base al tipo di paziente e di intervento: via timpanica, esofagea, nasofaringea, vescicale o in arteria polmonare. Quando l’intervento non lascia prevedere variazioni repentine della Tc possono essere utilizzate sia la temperatura rettale sia vescicale. I termometri a raggi infrarossi possono essere utilizzati per la misurazione della Tc attraverso la membrana del timpano.
2.5 Prevenzione dell’ipotermia
E’ raccomandata una temperatura ambiente compresa tra 24 e 27 °C con umidità relativa >40%. L’isolamento con teli riflettenti può ridurre la dispersione termica soprattutto se almeno il 50% della superficie corporea viene coperto (situazione inusuale nel bambino). Data l’importanza della perdita calorica per evaporazione, durante l’anestesia è consigliato l’uso di i filtri umidificatori così come circuiti rotatori con calce sodata. I riscaldatori di fluidi sono raccomandati in caso di somministrazione di grosse quantità di fluidi. Tra i sistemi esterni attivi quelli a raggi infrarossi dovrebbero essere utilizzati durante la preparazione alla anestesia prestando attenzione alle possibili ustioni. Tra i sistemi di riscaldamento attivo i materassi ad acqua possono essere efficaci solo se la superficie totale del bambino è inferiore a 0,5 m2 (10 Kg di peso corporeo). I sistemi ad aria forzata tipo forced air warming si sono dimostrati invece sempre efficaci (54).
|
Levitt RC. Termoregolazione in anestesia. In: Anestesia Clinica del Nord America. Verducci Editore, Roma, 1995.
Curley FS, Irwin RS. Disorders of temperature control Part I Hypothermia. In: Rippe J. Intensive care Medicine. Lippincot, 1991:658-86.
Bligth J, Johnson K. Glossary of terms for thermal physiology. J Appl Physiol 1973;35:941-61.
Sessler D. Temperature monitoring. In Miller RD, Ed. Anesthesia. 3rd ed., Churchill Livingston, New York 1990:1227-42.
Kurz A, Sessler D, Christensen R, Dechert M. Heat balance and distribution during the core temperature plateau in anaesthetized humans. Anesthesiology 1995;83:491-9.
Frank SM, Shir Y, Raja S, Fleisher LA, Beattle C. Core hypothermia and skin surface temperature gradients. Anesthesiology 1994;80:502-8.
Camus Y, Delva E, Lienhart A. Ipotermia intraoperatoria non provocata nell’adulto. Enciclopedia Medica Chirurgica. Elsevier Sci, Parigi 1999:36-413.
Hensel H. Neural processes in thermoregulation. Physiol Rev 1973;53:948-1008.
Holdcroft A. Body temperature control in anesthesia surgery and intensive care. Balleir-Tindall London, 1980.
Sessler D. Central thermoregulatory inhibition by general anaesthesia. Anesthesiology 1991;75:557-9.
Lenhart A, Delva E, Camus Y. Prevention de l’hypothermie peroperatorie in SFAR Conferences d’actualization. Masson 1992:265-79.
Matsukawa T, Sessler D, Sessler A, Schroeder M, Ozaky M, Kurz A, Cheng C. Heat flow distribution during induction of general anaesthesia. Anesthesiology 1995;82:662-73.
Emerick T, Ozakj M, Sessler D, Walters K, Scrhoeder B.A. Epidural anesthesia increases apparent leg temperature and decreases the shivering threshold. Anesthesiology 1994;81:289-98.
Ozaky M, Kurz A, Sessler D, Lenhart R, Scrhoeder M, Moayeri A, Noyes K, Rotheneder E. Thermoregulatory threshold during epidural and spinal anesthesia. Anesthesiology 1994;81:282-7.
Matsukawa T, Sessler D, Cristhensen R, Ozaky M, Scrhoeder M. Heat flow distribution during epidural anaesthesia. Anesthesiology 1995;83:961-7.
Berti M, Casati A, Torri G, Aldegheri G, Lugani D, Fanelli G. Active warming, not passive heat retention maintains normothermia during combined epidural-general anesthesia for hip and knee arthroplasty. J Clin Anesth 1997;9:482-6.
Joris J, Ozaki M, Sessler D, Hardy AF. Epidural anesthesia impairs both central and peripheral thermoregulatory control during general anesthesia. Anesthesiology 1994;80:268-77.
Busto R, Globus MY, Dietrich WD, et al. Effects of mild hypothermia on ischemia- induced release of neurotrasnsmitters and free fatty acids in rat brain. Stroke 1989;20:904-10.
Sanders B.J., D’Alesio J.G., Jerningam J.R.: Intraoperative Hypothermia associated with lower extremity tourniquet deflation J. Clin Anesth 1996;8: 504-507
Todd MM, Warmer DS. A comfortable hypothesis revaluated: cerebral metabolic depression and brain protection during ischemia. Anesthesiology 1992;76:161-4.
Leslie K, Sessler DI, Bijorkesten AR, Moayery M. A mild hypothermia alters propofol pharmacokinetiocs and increases the duration of action of atracurium. Anesth Analg 1995;80:1007-14.
Valeri CR, Cassidy G, Khury S, et al. Hypothermia induced reversible platelets dysfunction. Ann Surg 1987;205:594-610.
Reed l, Jhonston TD, Hudson D, Fisher RP. The disparity between hypothermic coagulopaty and clotting studies. J Trauma 1992;33:465-70.
Hansen D, Syben R, Vargas G, Spies C, M Welte. The alveolar –arterial difference in oxigen tension increase with temperature corrected determination during moderate hypothermia. Anesth Analg 1998;88:538-41.
Frank M, Fleisher L, Bresolow J, et al. Perioperative maintenance of normothermia reduces the incidence of morbid cardiac events. JAMA1997;277:1127-34.
Carli F, Kulkarni J, Webster D, Mc Donald A. Post surgery epidural blockade with local anesthetics attenuates the catecholamine and thermogenic response to perioperative hypothermia. Acta Anaesthesiol Scand 1995;39:1041-7.
Kurz A, Sessler D, Lenarhrdt R. Perioperative normothermia reduces the incidence of surgical wound infection and shorten hospitalisation. N Engl J Med 1996; 334:1209-15.
Carli F, Gabrielczyk M, Clark MM, Aber VR. An investigation of factors affecting postoperative rewarming of adult patients. Anaesthesia 1986;41:363-9.
Leslie K, Sessler D. reduction in the shivering threshold is proportional to spinal block height. Anesthesiology 1996:84:1237-31.
Sessler D, Ponte J. Shivering during epidural anaethesia. Anesthesiology 1990:72:816-21.
Sessler D, Rubistein E, Moayeri A. Physiologic responses to mild perianesthetic hypothermia in humans. Anesthesiology 1991;75:594-610.
Kurz M, Belani KG, Sessler D, Kurz A, Larson MD, Scrhoeder M. et al. Meperidina naloxone and shivering. Anestehsiology 1993;79:1193-201.
Berti M., Fanelli G., Casati A., Aldegheri G., Lugani D., Torri G.: Hypothermia: prevention and therapy. Anaesthesia 1998; 53(2): 46-47
Frank SM, Beattie C, Christopherson R, Norris EJ, et al. Epidural versus general anaesthesia, ambient operating room temperature and patients age as predictors of inadvertent ipothermia. Anesthesiology 1992;77:252-57.
Vaughamn MS, Vaughan RW, Cork RC. Postoperative hypothermia in adult relationship of age anaesthesia and shivering to rewarming. Anesth Analg 1981;60:746-51.
Kurz A., Sessler D., Narzt E., Lenhart R.: Morphometric influences on intraoperative core temperature changes. Anesth. Analg.1995; 80: 562-567
Delibera Giunta Regionale Lombardia: definizione dei requisiti minimi 22/01/1998
El Gamal N., El Kassambany N., Frank S. Et coll.: Age related thermoregulatory differences in a warm operating room enviroment (Approximately 26° C) Anesth Analg 2000; 90: 694-698
Bikler P, Sessler D. Efficiency of airway heat and moinsture exchangers in anaesthetized humans. Anesth Analg 1990;71:415-8.
Williams R, Rankin N, Smith T, et al. Relationship between the humidity and temperature of inspired gas and the function of the airway mucosa. Crit Care Med 1996;24:1920-30.
Pagni E. Anestesia e Termoregolazione 1988 Ed La Garangola Padova
Feries G, Johnston C, Pruit KM, Plouff RT. Temperature relationship to distance and flow rate of warmed IV fluid. Ann Emerg Med 1991;20:1189-200.
Presson GR, Berzucko A, Hiller S, McNice W. Evaluation of a new fluid warmer effective at low to moderate flow rate. 1993;78:974-80.
Gousouzian N, Morris R, Ryan J. The effect of warming blanket on the maintenance of body temperature in anaesthetized infant and children. Anesthesiology 1973;39:351-7.
Glosten B, Hynson J, Sessler D, McGuire J. Preanesthetic skin surface warming reduces redistribution hypothermia caused by epidural blockade. Anesth Analg 1993;77:488-93.
Casati A, Baroncini S, Pattono R, et al. Effects of sympathetic blockade on the efficiency of forced air warming during combined spinal/epidural anesthesia for total hip arthroplasty. J Clin Anesth 1999;11:360-3.
Sesler D. Mild perioperative hypothermia. N Engl J Med 1997;336:1730-7.
Cork R, Vaugham R, Humprhey L. precision and accuracy of intraoperative monitoring. Anesth Analg 1983;62:211-4.
Ticket WT, Ahlgeren WE, Stephen CR. Body temperature monitoring via the tympanic membrane. Surgery 1970;67:981-4.
Webb G. Comparison of oesophageal and tympanic temperature monitoring during cardiopulmonary by-pass. Anesth Analg 1973;52;5-10.
Robinson J, Charlton J, Seal R, Spady D, Joffres MR. Oesophageal rectal axillary tympanic and pulmonary artery temperatures during cardiac surgery. Can J Anaesth 1998;45:317-23.
Bissonette B, Davis P. Thermal regulation physiologyand perioperative management in infant and children. In: Basic principles in pediatric anaesthesia. pp 139-58.
Sessler D. Temperature regulation in Paediatric Anaesthesia In Gregory G Pediatric Anesthesia 3° Edition 1994 Curchill Livingstone
Kurz A, Kurz M, Poeschl G, et all. Forced air warming maintains intraoperative normothermia better than circulating water mattresses. Anest. Analg 1993:77:89-95.
Richiesta Estratti:
Dr M Berti, Dip Anestesia e Rianimazione
IRCCS H San Raffaele,
via Olgettina 60, 20132 Milano
Tel: 0226432656
Fax: 0226412823