

ISSN 1080-3521
EDUCATIONAL SYNOPSES IN ANESTHESIOLOGY
and
CRITICAL CARE MEDICINE - Italia -
|
|
Copyright (C) 1997 Educational Synopses in Anesthesiology and Critical Care Medicine. All rights reserved. Questo rivista on-line può essere copiata e distribuita liberamente curando che venga distribuita integralmente, e che siano riportati fedelmente tutti gli autori ed il comitato editoriale. Informazioni sulla rivista sono riportate alla fine | |
In questo numero:
1 CONSIDERAZIONI FISIOPATOLOGICHE SULL'OSSIGENAZIONE NEI PAZIENTI BPCO: INTERAZIONE CUORE - POLMONE
2 CRITERI PER L'AMMISSIONE DI UN PAZIENTE CHIRURGICO IN T. I.
3 Emofiltrazione continua in rianimazione
4
Manuali di Anestesia:
Anestesia in chirurgia addominale - Pancreasectomia: resezione
sec. Wipple
_______________________________________________________
1 CONSIDERAZIONI FISIOPATOLOGICHE SULL'OSSIGENAZIONE NEI PAZIENTI BPCO: INTERAZIONE CUORE - POLMONE
_______________________________________________________
Elio Virone
Divisione di Pneumologia - Azienda
Ospedaliera "S. Elia" - Caltanissetta
Summary:
The oxygen-therapy corrects hypoxaemia in COPD patients in which
revails a inequality of ventilation/perfusion ratio. But it is
necessary to consider haemodinamic parameters for the improvement
of the oxygen gaseous exchanges, and the transport and use of
oxygen in periphery. The mechanical interactions heart-lung conditions
the performances of the cardiovascular system of the patients
with copd.
Key Words: Haematosys. Haemodimamic Parameters.
Nella composizione dell'aria inspirata
si rileva una frazione di ossigeno (FIO2) del 21% con una relativa
pressione parziale (PIO2) di 150 mmHg; quest'ultimo valore deriva
dal prodotto della frazione di ossigeno inspirato per la pressione
atmosferica ridotta del vapore acqueo: PIO2 = 0,21 x 713. L'ossigenoterapia
è capace di accrescere la FIO2 dal 21% al 35 - 40 % e oltre,
a seconda dei flussi erogati. Tale incremento influirà
sui valori della Pressione Alveolare dell'Ossigeno secondo la
relazione: PAO2 = PIO2 - PaCO2/R. Tale relazione esprime l'equazione
dei gas alveolari e determina il valore della tensione di ossigeno
nell'alveolo e condiziona una delle variabili della PaO2 misurata
dall'emogasanalisi. Infatti le cause generali che possono determinare
ipossiemia sono schematizzate nella fig. 1.
 | fig.1 |
Il valore della PaCO2 misurato all'emogasanalisi
invece è, a metabolismo costante, funzione inversa della
Ventilazione Alveolare (VA): PaCO2 = VCO2 / VA: il termine VA
può essere scritto come Ve (1- Vd/Vt), dove Ve è
il volume minuto e Vd/Vt è lo spazio morto fisiologico.(fig.2)
 | fig.2 |
Nel paziente con bpco e limitazione al flusso espiratorio, l'alto carico meccanico (resistenze elastiche, dinamiche, Peep intrinseca) e la riduzione della forza muscolare (alterata geometria diaframmatica) producono un profilo respiratorio tale da determinare accorciamento del tempo inspiratorio, riduzione del volume corrente ed aumento dello spazio morto fisiologico con conseguente diminuzione della Ventilazione Alveolare ed ipercapnia. (1,2)
Lo scopo dell'ossigenoterapia rimane
non tanto quello di accrescere in senso assoluto il valore della
PaO2, ma quello di correggere e\o prevenire l'ipossia tessutale
senza provocare "pericolosi" incrementi della PaCO2.
Un indice molto attendibile di valutazione dell'ossigenazione
tessutale rimane, se pur con qualche limite, la PvO2. Tale parametro
ci informa sugli "scambi periferici" di ossigeno tra
capillare e cellula: il valore normale è di 40 mmHg con
una saturazione venosa mista del 75 %. Valori inferiori indicano
un inadeguato apporto di ossigeno ai tessuti che cominciano a
mostrare segni di sofferenza ipossica per valori di PvO2 minori
di 30 mmHg. Le condizioni in cui tali indici non sono predditivi
di ipossia tessutale sono lo stato di sepsi e il Distress Respiratorio
dove possono anche risultare nella norma, pur permanendo una severa
ipossia cellulare dovuta a turbe metaboliche per alterazioni nell'estrazione
di ossigeno. La PvO2 inoltre, rilevando la pressione di tutto
il sangue venoso refluo, non ci informa sulle eventuali sofferenze
ipossiche distrettuali. (3,4)
Nella valutazione dell'ossigenazione bisogna considerare altri tre importanti parametri: il contenuto arterioso di ossigeno, l'indice cardiaco (I.C.) e il flusso ematico periferico. Il contenuto arterioso (CaO2) è principalmente legato alla quota di ossigeno trasportata dall'emoglobina, essendo trascurabile, in normobarismo, la quota disciolta nel plasma:
CaO2 = Hb x 1,34 x %Sat. O2. La portata
cardiaca assicura il trasporto di ossigeno verso i tessuti la
cui disponibilità è espressa dalla relazione: DO2
= CaO2 x I.C. . Una buona ossigenazione tessutale dipende allora
dalla interrelazione tra scambio gassoso, emoglobina e indice
cardiaco (4). Gli scambi gassosi avvengono sempre secondo i gradienti
di ventilazione e di perfusione regionali del parenchima polmonare
con il risultato di un rapporto ventilazione\perfusione globale
eguale a 0,8. Ogni condizione patologica che altera questo rapporto
sarà causa di ipossia ipossiemica. In corso di BPCO la
causa fondamentale di ipossiemia risiede appunto nella diseguaglianza
del rapporto V\Q . (Fig.3)
| fig.3 | |
Tale condizione può essere studiata attraverso la relazione PaO2 - PaCO2 espresso dal diagramma di Fenn, oppure seguendo le curve di eliminazione dei gas inerti (5). Secondo il citato diagramma, tutte le condizioni che spostano il punto arterioso di ossigeno verso quello venoso misto sono dovute a commistione venosa (basso V\Q); le condizioni che invece spostano il punto alveolare di ossigeno verso il punto inspiratorio, sono responsabili dell'effetto spazio morto fisiologico (alto V\Q). La distanza tra il punto alveolare e l'arterioso costituisce la differenza alveolo-arteriosa di ossigeno. Nei pazienti BPCO esistono aree polmonari disomogenee per rapporto V\Q: aree con prevalente commistione venosa ed aree con prevalente effetto spazio morto fisiologico. A tale proposito l'analisi delle curve di eliminazione ci rende più esplicito il disegno intraparenchimale: nel paziente enfisematoso la ventilazione assume un andamento bimodale distribuendosi maggiormente verso aree ad alto V\Q, invece poca quota di perfusione raggiunge alveoli con basso V\Q. Tale disposizione rende ragione della relativa scarsa ipossiemia a riposo di questi pazienti. Nel bronchitico cronico di tipo B si assiste per converso ad una distribuzione della perfusione maggiormente diretta a zone con basso V\Q : ciò rende evidente la maggiore ipossiemia a riposo di tali pazienti. (5)
Tutte queste turbe della distribuzione
intrapolmonare dell'aria inspirata possono ancora essere studiate
da altri parametri: come la D(A-a)O2 e i rapporti PaO2/PAO2 e
PaO2/FiO2. La differenza alveolo-arteriosa risulterà alta
in caso di grave diseguaglianza del rapporto V\Q, e viene corretta
o si riduce in ossigenoterapia. Rimane invece molto elevata o
tende a peggiorare in caso di shunt (V\Q = 0) e non si corregge,
o anzi si incrementa, in ossigenoterapia. In corso di ipoventilazione
alveolare invece il valore di tale equazione rimane nella norma.
La differenza alveolo-arteriosa è molto sensibile alle
variazioni della frazione inspirata di ossigeno e di ciò
bisogna sempre tenerne conto nel calcolo. Invece poca variazione
rispetto alla FiO2 ha il rapporto PaO2/PAO2: la sua diminuzione
sotto 0,75 è indice di commistione venosa. La diminuzione
del rapporto PaO2/FiO2 sotto i 200 è indice di grave commistione
venosa. Queste turbe dell'ematosi, e le sue possibili correzioni
in ossigenoterapia, tuttavia non esauriscono le variabili da cui
dipende l'ossigenazione arteriosa e di conseguenza quella tessutale.
Bisogna infatti considerare, con pari dignità, le variazioni
che gli indici emodinamici (6) hanno nel determinare adeguati
livelli di saturazione arteriosa, proprio nei pazienti BPCO. Fig.4
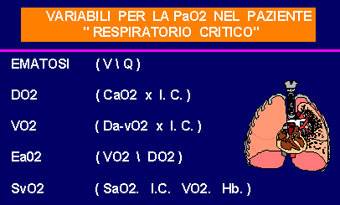 |
fig.4 |
DO2= Trasporto di ossigeno
VO2= Consumo di ossigeno
EO2= Estrazione di ossigeno
SvO2=Saturazione venosa mista
Infatti tali pazienti hanno una compromissione
dell'attività cardiaca di base sia perché già
cardiopatici di base (la broncopatia cronica ostruttiva si accompagna
molto spesso ad alterazioni della funzione ventricolare sinistra
fig.5 (7) ; sia perché
 |
fig.5 |
contraggono una cardiopatia polmonare,
sostenuta dall'elevata impedenza arteriolare del ventricolo destro
su base ipossica, o ancora, perché sottoposti a ventilazione
meccanica. In tali condizioni si può determinare una alterazione
della gettata cardiaca con peggioramento della disponibilità
di ossigeno in periferia. La compromissione dell'attività
cardiaca nei pazienti BPCO, più che determinata da un difetto
dell'inotropismo o dalla comparsa di un' insufficienza globale,
è più spesso causata dalla riduzione della funzione
diastolica del ventricolo sinistro, sia per disfunzione nella
fase di rilasciamento attivo isovolumetrico, sia per modificazione
della compliance ventricolare a causa della patologica dislocazione
del setto verso sinistra, a motivo della dilatazione ventricolare
destra, che altera la geometria della camera ventricolare sinistra
(interdipendenza) e la fase di riempimento (8). Inoltre la funzione
sistolica del V.S. condiziona il gradiente ematico di riempimento
dx-sn, ed ogni deficit della curva lavoro-tensione del V.S. si
ripercuoterà nel settore destro provocando ipertensione
venosa ed edema interstiziale polmonare con ulteriore compromissione
degli scambi gassosi.(8,9) (fig.6.7)
 |
 |
| fig.6 | fig.7 |
Alla riduzione della portata cardiaca, i tessuti rispondono con una maggiore capacità di estrazione, al fine di mantenere costante il consumo di ossigeno, determinando una relativa desaturazione del sangue venoso misto che ritornerà al polmone con una più bassa tensione di ossigeno: questa riduzione di SvO2 è responsabile di gravi desaturazioni arteriose anche se gli scambi gassosi rimangono stabili. Tale situazione sarà ancora più grave nei pazienti con aree a basso V\Q, dove l'ossigenazione di base è già compromessa dall'ematosi e viene ulteriormente aggravata dalla bassa saturazione venosa: il risultato complessivo sarà quello di una severa ipossiemia. Questa alterazione è difficilmente correggibile con l'aumento della ventilazione spontanea in ossigeno per la nota relazione sigmoidea della curva di dissociazione dell'Hb: la PaO2 delle zone con normale ematosi non riesce a "correggere" la bassa PaO2 delle zone con grave commistione venosa: in questo caso la PaO2 risultante non sarà la media delle PaO2 distrettuali, ma sarà condizionata dai rispettivi contenuti arteriosi con conseguente mantenimento dell' ipossiemia. Tale condizione risente invece favorevolmente dell'incremento della SvO2: aumentando infatti l'indice cardiaco di questi pazienti con un adeguato supporto inotropo, si ripristina il rapporto di estrazione di ossigeno in periferia (EO2= VO2\DO2) e si ristabilisce la normale SvO2, realizzandosi una riduzione dell'effetto ipossiemizzante sul sangue arterioso da parte di zone polmonari a basso V\Q .(10,11)
Da queste premesse fisiopatologiche risulta come nel paziente BPCO ipossiemico non conviene attribuire a turbe dell'ematosi quanto invece può essere dovuto a turbe emodinamiche. Per queste ragioni e in questi pazienti, noi sosteniamo sempre la funzione di pompa del cuore, impiegando come supporto inotropo la Dobutamina in infusione venosa a 10 mcg/kg/min., (12) anche senza segni clinici evidenti di scompenso, ottenendo, assieme ad un programma di ossigenoterapia o di ventilazione non invasiva, una migliore e stabile ematosi.
Tale approccio migliora la prognosi
dei pazienti BPCO che, come ormai documentato in letteratura (13,14),
dipende dalla capacità di incrementare la portata cardiaca
e di migliorare PvO2 e SvO2. Fig.8,9,10,11,12
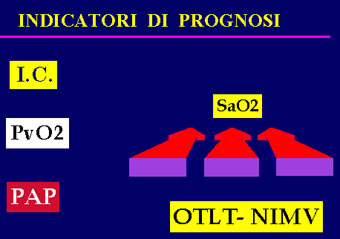 |
fig.8 |
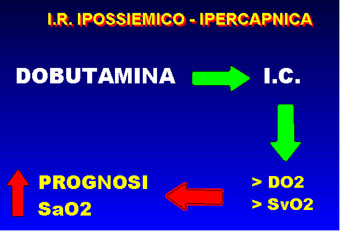 |
fig.9 |
 |
fig.10 |
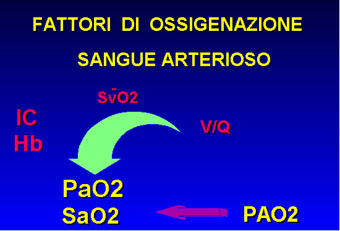 |
fig.11 |
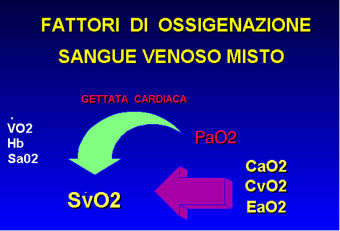 |
fig.12 |
PAP= Pressione Polmonare
OTLT= Ossigenoterapia
NMV= Ventilazione Meccanica Non Invasiva
La SvO2 è direttamente proporzionale
all' I.C. se rimangono costanti metabolismo, consumo di ossigeno
e contenuto di emoglobina. A parità di ipossiemia-ipercapnia
la prognosi dipende dalla stabilità cardio-circolatoria.
Tra l'altro questa condizione è già insita nel compenso
fisiologico all'ipossiemia: i pazienti aumentano spontaneamente
il loro indice cardiaco ( in ciò favoriti dall'effetto
della CO2 sul sistema cardiovascolare). Gli altri meccanismi di
adattamento all'ipossiemia: vasocostrizine ipossica, poliglobulia
e spostamento a destra della curva di dissociazione sono meno
importanti dell'incremento dell'indice cardiaco , che rimane il
meccanismo più efficace e teleologicamente più significativo
in risposta all'ipossiemia. Inoltre, l'incremento della portata
consentirà maggior rifornimento di ossigeno ai mm. respiratori
che aumenteranno la loro resistenza al lavoro respiratorio con
diminuzione progressiva della capnia, che dipende anche dalla
validità dell'indice cardiaco.(12) (fig.13)
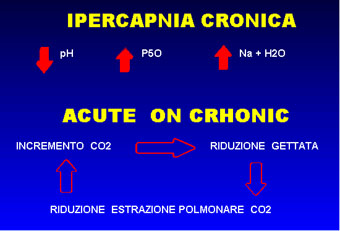 |
fig.13 |
L'ossigenoterapia controllata o la ventilazione meccanica non invasiva diventano allora una utile e necessaria pratica clinica in pazienti BPCO selezionati, ma devono essere necessariamente integrati dal raggiungimento di una buona efficienza emodinamica che assicura il trasporto e l'utilizzazione ottimale di ossigeno a livello mitocondriale, che è il vero processo della "respirazione". L'obiettivo terapeutico rimane quello di portare a valori sopramassimali gli indici emodinamici, in ciò favoriti dall'impiego della Dobutamina.(7,12,15,16)
 | 
|
| fig.14 | fig.15 |
 | 
|
| fig.16 | fig.17 |
Nel quadro generale della fisiopatologia
dei pazienti con broncopatia cronica bisogna anche valutare le
interazioni cuore-polmone in respiro spontaneo e in ventilazione
meccanica, sotto l'aspetto meccanico e circolatorio. Questi concetti
sono stati di recente studiati e rivisitati nell'approfondimento
dei problemi che riguardano la "fossa cardiaca". In
pratica il cuore può essere considerato come una pompa
che funziona dentro un'altra pompa: quella toraco polmonare (fig.18).
Da ciò risultano interdipendenti le pressioni e i volumi
toracici con l'attività cardiaca e il sistema della circolazione
polmonare e sistemica.(17)
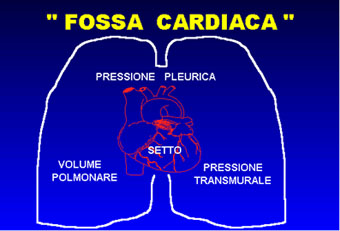 |
fig.18 |
1° EFFETTI MECCANICI
Durante l'inspirazione spontanea i polmoni
aumentano di volume e "stringono" il cuore proporzionalmente
all'inflazione (responsabile dell'iperinflazione polmonare in
corso di bpco è anche la compressione dinamica delle vie
aeree che genera la Peep i) .L'azione costrittiva è minore
in respiro spontaneo che in IPPV (Ventilazione a Pressione Positiva
Intermittente). L'azione meccanica costrittiva dei polmoni influenza
in particolare la funzione diastolica, opponendosi alla distensione
delle cavità cardiache; tale fenomeno comporta riduzione
della portata dovuta a riduzione del precarico. In respiro spontaneo
la discesa inspiratoria del diaframma attenua l'effetto costrittivo
del polmone per abbassamento della loggia cardiaca (18). Nel paziente
in IPPV curarizzato, il diaframma risale sotto la spinta dei visceri
addominali e la sua azione costrittiva si somma a quella operata
dai polmoni insufflati.
2° EFFETTI CIRCOLATORI
Cuore e Polmoni sono collegati in serie
dalla circolazione polmonare. Il circolo polmonare costituisce
il post-carico del ventricolo destro, ma anche la "riserva
ematica" del ventricolo sinistro. Un cuore polmonare cronico
tollera meglio del sano un aumento acuto di pressione polmonare.
I vasi extralveolari si dilatano in inspirazione spontanea e collabiscono
in espirazione in relazione alla risposta alle forze radiali cui
vengono sottoposti attraverso i tralci connettivali perivascolari.
Per i vasi intraalveolari avviene l'opposto: si dilatano in espirazione
e collabiscono in inspirazione a causa della pressione endoalveolare.(8,19)
Aumento o diminuzione di CFR sono responsabili di aumento di resistenza
vascolare polmonare. Questi fenomeni si verificano in respiro
spontaneo che in IPPV. L'inspirazione spontanea provoca aumento
del ritorno venoso al cuore destro, ma contemporaneamente una
dilatazione del letto vascolare polmonare con aumento della capacità
vascolare e riduzione di sangue al cuore sinistro: in fase espiratoria
invece la quota ematica accumulata nel reservoir polmonare viene
"spremuta" al cuore sinistro con aumento della gettata.(18).
La riduzione della pressione pleurica in fase inspiratoria determina
una diminuzione della pressione atriale destra e favorisce il
ritorno venoso. Nel contempo la depressione pleurica provoca un
incremento del lavoro del ventricolo sinistro per aumento della
pressione transmurale con il risultato di una depressione della
frazione di eiezione ventricolare sn.: ciò comporta un
maggiore volume ematico intratoracico. Un aumento della pressione
pleurica (in corso di ventilazione) riduce il ritorno venoso al
cuore destro ed incrementa l'eiezione ventricolare sinistra con
riduzione del volume ematico intratoracico. Anche le variazioni
della pressione transdiaframmatica influiscono sul ritorno venoso
per lo spostamento di massa ematica dal letto splancnico verso
il torace in fase inspiratoria spontanea. Nel caso di paralisi
muscolare durante ventilazione controllata il ritorno ematico
addominale non è favorito dal diaframma che si muove in
modo passivo con scarse variazione di pressione.
3° PRESSIONE INTRATORACICA
Si è sempre
sostenuto che in corso di
IPPV, la funzione cardiaca avesse una riduzione di volume e di
compliance: il ruolo della Pressione Intratoracica tuttavia è
stato rivisto alla luce di modificazioni emodinamiche sulla pressione
transmurale del ventricolo sinistro insufficiente (PtmVS). In
pratica il post carico del ventricolo sinistro (che nel cuore
scompensato condiziona la gettata cardiaca più del precarico
e della contrattilità ) si modifica favorevolmente in corso
di IPPV. Infatti la pressione transmurale del VS migliora in ventilazione
positiva comportando una riduzione del post carico ventricolare
con miglioramento della gettata cardiaca. La pressione intratoracica
negativa è responsabile di una pressione transmurale del
VS maggiore di quella prodotta da una pressione intratoracica
positiva: ne deriva un aumento dello stess di parete del VS. In
corso di IPPV si modifica infatti favorevolmente lo stress di
parete del VS che, per la legge di Laplace, è dato da:
"Tensione di parete = Pressione x Raggio." La Pressione
in questo caso è la Pressione Transmurale (differenza tra
la pressione intracardiaca e la intratoracica) che appunto diminuisce
con l'impiego di una pressione di ventilazione positiva, comportando
una riduzione della tensione parietale. La riduzione della pressione
transmurale del VS ottenuta in ventilazione meccanica equivale
ad una riduzione del post-carico (fig.19) e quindi al miglioramento
della curva di lavoro del VS nel cuore "insufficiente".
Molti casi di svezzamento dalla pressione positiva falliscono
(20) proprio perché il cuore non è più "sostenuto"
nelle sue funzioni e non tanto per il mancato raggiungimento dei
parametri di ventilazione spontanea (volume corrente, frequenza
respiratoria, capacità vitale, drive centrale) Quest'ultima
considerazione sostiene maggiormente l'intuizione di un approccio
inotropo con Dobutamina anche durante lo svezzamento dal respiratore
dei pazienti con Bpco scompensata. (12)
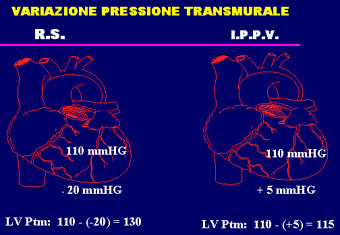 |
fig.19 |
R.S (Respiro Spontaneo)
IPPV (Ventilazione in Pressione Positiva)
LVPtm (Pressione Transmurale)
| R. S. | I.P.P.V. |
| Pressione Ventricolare = 110 mmHg | Pressione Ventricolare = 110 mmHg |
| Pressione Intratoracica = - 20 mmHg | Pressione Intratoracica = 5 mmHg |
| PtmVS = 110 - (-20) = 130 mmHg | PtmVS = 110 - (+5) = 105 mmHg |
BIBLIOGRAFIA
_______________________________________________________
2 CRITERI PER L'AMMISSIONE DI UN PAZIENTE CHIRURGICO IN T. I.
_______________________________________________________
Francesco Corrado
Email: fcorrado@iol.it
La disponibilità di posti letto per il monitoraggio intensivo di pazienti chirurgici può forse garantire un miglioramento dell'outcome nei pazienti maggiormente a rischio di complicanze postoperatorie a causa di patologie concomitanti (1). Non si dimentichi l'alta incidenza di comparsa di ischemie cardiache intra e postoperatorie (2,3,4,5) anche se la scelta della tecnica di anestesia può modificare in maniera significativa il decorso (6). Il nodo da sciogliere è però costituito dai criteri di selezione dei pazienti da inviare in Terapia Intensiva dopo un intervento. In altri termini è necessario effettuare una valutazione costi-benefici che si rifletterà su decisioni di tipo economico/finanziario.
Sarà quindi opportuno dotarsi di uno strumento di valutazione che consenta, mediante uno score ricavato da una serie di parametri clinico - anamnestici, di decidere l'opportunità o meno di un monitoraggio intensivo.
Si comprende la potenziale rigidità di una tale metodica, ma lo scopo ultimo è quello di ottenere una uniformità oggettiva di comportamento, comunque non disgiunta da margini di discrezionalità .
Un'ultima considerazione, ma non per questo meno importante è quella dell'aspetto medico - legale. Non dobbiamo infatti dimenticare le implicazioni che possono scaturire sia da un mancato monitoraggio di un paziente, specie in situazioni border line, sia da un monitoraggio ritenuto superfluo per le conseguenze economiche che comporta e per eventuali complicanze (flebiti da CVC, arteriti da misurazione cruenta della PA ecc.).
La classificazione ASA (7) può essere vantaggiosamente impiegata per la valutazione clinico-anamnestica, assegnando a ciascuna classe un punteggio:
Le classi 1 e 2 ASA (semplice valutazione preoperatoria) non necessiteranno sicuramente di un monitoraggio postoperatorio a meno che non intervengano fattori di previsione che esporremo di seguito.
La chirurgia maggiore, intesa come coinvolgimento diretto di organi o apparati che svolgano essenziali funzioni metaboliche, o che comporti estese demolizioni con perdite ematiche consistenti, contribuisce senz'altro ad accrescere il punteggio. La durata del'intervento, con la imponente perdita di calore che ne consegue è un altro fattore che suggerisce un periodo di monitoraggio e di ripristino dei parametri biologici (8,9).
| punti | |
| Età > 70 | 2 |
| Intervento di chirurgia maggiore | 3 |
| VALUTAZIONE INTRAOPERATORIA | |
| 3 |
| |
| se < 90' | 0 |
| se > 90' ma < 3 ore | 2 |
| se compresa tra 3 e 6 ore | 3 |
| se > 6 ore | 5 |
| 5 |
| |
| < 36° C | 2 |
| < 35° C | 3 |
| < 34° C | 6 |
| 10 |
VALUTAZIONE DELLO SCORE
CLASSIFICAZIONE A S A (American Society of Anesthesiologists)
| Nessuna alterazione organica, biochimica o psichiatrica | |
| Modesto disturbo sistemico che può o no essere correlato alla causa dell'intervento | |
| Grave malattia sistemica correlata o no alla regione dell'intervento | |
| Grave malattia che pregiudica la sopravvivenza indipendentemente dall'intervento chirurgico | |
| Paziente moribondo con scarse possibilità di sopravvivenza e che viene sottoposto all'intervento come ultima possibilità | |
| Ogni intervento non dilazionabile e che pertanto non consente una completa valutazione del paziente e la correzione di ogni squilibrio. La lettera E viena aggiunta alla corrispettiva classe ASA |
DIMISSIONE DI PAZIENTI CHIRURGICI DALLA TERAPIA INTENSIVA
Per la dimissione dei pazienti in monitoraggio intensivo sarà opportuno adottare criteri di valutazione quanto più oggettivi possibile come si è cercato di fare per l'ammissione. Lo scopo è evidentemente quello di ridurre al minimo indispensabile la permanenza in una struttura che impegna risorse umane e tecniche del tutto particolari. Escludendo le classi III, IV, V ASA che obbligano comunque al monitoraggio intensivo ma sovente anche alla vera e propria rianimazione, si può notare come lo score finale sia prevalentemente dovuto ad eventi intra-operatori: perdite ematiche con o senza instabilità emodinamica, durata dell'intervento ed eventuale ipotermia.
E' pertanto evidente che il ristabilimento
di parametri biologici compatibili con quelli pre-operatori sarà
un valido criterio per restituire il paziente al reparto di provenienza
dove potrà essergli assicurata una degenza senza dubbio
più confortevole.
PROTOCOLLO DI VALUTAZIONE DEI CRITERI DI AMMISSIONE DI UN PAZIENTE CHIRURGICO IN TERAPIA INTENSIVA
| ASA (I II III IV V) + età | |
| Intervento di chirurgia maggiore | |
| Perdita ematica > 150 ml/ora | |
| Durata intervento | |
| Instabilità emodinamica o alter. ritmo cardiaco | |
| Temperatura corporea | |
| Insufficienza ventil. Postoperatoria | |
| Invio in terapia Intensiva | no | si |
| Durante il ricovero in UTI si sono verificate complicanze pericolose per la vita | no | si |
| Complicanze postoperatorie (in reparto di degenza) | no | si |
| respiratorie.................................................... | ||
| cardiocircol................................................... | ||
| renali............................................................ | ||
| epatiche........................................................ | ||
| legate all'intervento................................... | ||
| settiche......................................................... | ||
| Le complicanze in reparto di degenza hanno richiesto il ricovero in UTI | no | si |
| Le complicanze hanno prolungato il tempo di degenza oltre i valori medi per il tipo di interbento effettuato | no | si |
Bibliografia
1 Hatton F., et al. - INSERM. Epidemiological survey of anesthesia. Initial results. Ann. Fr. Ann. Fr. Anesth. Réanim. 2(5) : 331-86, 1983
2 London M.J., et al. - Intraoperative myocardial ischemia: localization by continuous 12 - lead electrocardiography. Anesthesiology. 1988 Aug; 69(2) : 232-41
3 Hollenberg M., et al. Therapeutic approaches to postoperative ischemia. The Study of Perioperative Ischemia Research Group. Am. J. Cardiol. 1994 Mar 10; 73(6) : 30B-33B
4 Mangano D.T.,et al. Perioperative myocardial ischemia in patients undergoing noncardiac surgery--I: Incidence and severity during the 4 day perioperative period. The Study of Perioperative Ischemia (SPI) Research Group. J. Am. Coll. Cardiol. 1991 Mar 15; 17(4):843-50
5 Mangano D.T., et al. Perioperative myocardial ischemia in patients undergoing non-cardiac surgery--II: Incidence and severity during the 1st week after surgery. The Study of Perioperative Ischemia (SPI) Research Group. J. Am. Coll. Cardiol. 1991 Mar 15;17(4) : 851-7
6 Christopherson R., et al. Perioperative morbidity in patients randomized to epidural or general anesthesia for lower extremity vascular surgery. Perioperative Ischemia Randomized Anesthesia Trial Study Group. Anesthesiology. 1993 Sep; 79(3) : 422-34
7 Recommendations for intensive care unit admission and discharge criteria. Task force on guidelines - Society of Critical Care Medicine. Critical Care Med. Vol. 16, No 8: 807-808.
8 American Society of Anesthesiologists. New classification of physical status. Anesthesiology 1963; 24 : 111
9 Frank S.M., et al. Unintentional hypothermia is associated with postoperative myocardial ischemia. The Perioperative Ischemia Randomized Anesthesia Trial Study Group. Anesthesiology. 1992 Aug; 77(2) : 252-7
10 Frank S.M., et al.; Epidural versus general anesthesia, ambient operating room temperature, and patient age as predictors of inadvertent hypothermia. Anesthesiology. 1992 Aug; 77(2) : 252-7