

ISSN 1080-3521
EDUCATIONAL SYNOPSES IN ANESTHESIOLOGY
and
CRITICAL CARE MEDICINE - Italia -
Il giornale Italiano online di anestesia Vol 7 No 9 Settembre 2002
Vincenzo Lanza, MDServizio di Anestesia e RianimazioneOspedale Buccheri La Ferla Fatebenefratelli Palermo, ItalyE-mail: lanza@mbox.unipa.it |
Keith J Ruskin, MDDepartment of Anesthesiology Yale University School of Medicine333 Cedar Street, New Haven, CT 06520 USAE-mail: ruskin@gasnet.med.yale.edu |
Copyright (C) 1997 Educational Synopses in Anesthesiology and Critical Care Medicine. All rights reserved. Questo rivista on-line può essere copiata e distribuita liberamente curando che venga distribuita integralmente, e che siano riportati fedelmente tutti gli autori ed il comitato editoriale. Informazioni sulla rivista sono riportate alla fine |
|
In questo numero:
ATTI CONGRESSUALI ONLINE XVII Congresso
Nazionale della Società Italiana di Terapia Intensiva S.I.T.I
dal corso "Tecniche di depurazione extra-renale continua in Terapia Intensiva"
2 La Potassiemia
_______________________________________________________
ATTI CONGRESSUALI ONLINE
XVII Congresso
Nazionale della Società Italiana di Terapia Intensiva S.I.T.I.
La redazione di Esia-Italia dedica
alcuni suoi numeri alla
presentazione online di una selezione degli atti del XVII Congresso Nazionale
SITI (Società Italiana di Terapia Intensiva), tenutosi nel Settembre 2003 a
Palermo.
Attraverso ESIA, i
presidenti, il comitato organizzatore e il comitato scientifico del congresso SITI hanno
deciso di offrire il materiale scientifico congressuale per la libera
consultazione online, certi di incontrare il bisogno di formazione e di
aggiornamento dei lettori: anestesisti-rianimatori, infermieri, chirurghi e altri
addetti ai lavori dell'area critica. La selezione degli articoli spazia tra le
diverse aree di interesse, valorizzando le competenze mediche e
infermieristiche delle tematiche trattate, a sottolineare che solo una crescita
culturale di tutto il gruppo di lavoro può garantire i migliori risultati di
cura sui pazienti critici.
Pertanto Esia-Italia, perseguendo le proprie finalità costitutive di strumento
elettronico di formazione scientifica e tecnica, si offre come canale di pubblicazione dei lavori
congressuali; in
ogni caso la redazione di Esia-Italia non si riterrà responsabile di errori o
di omissioni ravvisabili nei testi prodotti nè dell'eventuale impropria
utilizzazione delle tecniche descritte.
_______________________________________________________
Bilancio dell'Acqua ed Equilibrio del Sodio
_______________________________________________________
D. Grimaud, C. Ichai (Nizza)
L'EQUILIBRIO IDRICO
L'ACQUA NELL'ORGANISMO
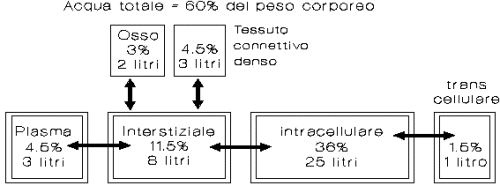 |
L'acqua
è il solvente e la componente quantitativamente più importante dell'organismo.
L'acqua totale rappresenta dal 50 al 70% del peso corporeo dell'adulto variando
secondo l'età, la massa sanguigna, ed il rapporto tra massa magra e grasso. I
tessuti più ricchi di acqua sono il cervello, i muscoli, la pelle ed il sangue.
Più che la quantità totale è importante la ripartizione intra/extracellulare
dell'acqua.
L'acqua
totale è distribuita in 2 settori fondamentali:
Intracellulare:
rappresenta dal 40 al 50% del peso corporeo, ricca in K+ e povera in
Na+.
Extracellulare:
rappresenta dal 20 al 25% del peso corporeo e comprende due ulteriori settori:
a) plasmatico, ricco in Na+ e proteine che costituisce il volume sanguigno o volemia;
b) interstiziale, costituito dall'acqua che circonda le cellule, dall'acqua delle sierose, del liquido cefalo-rachidiano, della linfa, etc.
La
composizione dell'acqua interstiziale è simile a quella del plasma, tranne che
per la sua povertà in proteine. Le alterazioni di questo settore comportano la
costituzione di un terzo spazio che raccoglie i liquidi che costituisce così
l'edema.
I MOVIMENTI DELL'ACQUA TRA I
DIFFERENTI COMPARTIMENTI E LA LORO REGOLAZIONE
L'acqua
è in continuo movimento tra i diversi settori grazie a due grandi superfici di
scambio: la membrana cellulare e la parete capillare.
Il
passaggio dell'acqua attraverso la membrana cellulare avviene per movimenti
passivi che sono regolati dalle leggi dell'osmosi.
La ripartizione dell'acqua tra settore intra ed extracellulare è quindi determinata dalle concetrazioni di sostanze osmoticamente attive: l'acqua sarà richiamata dalle zone più ricche di sostanze osmoticamente attive. L'idratazione cellulare, quindi, dipende dall'osmolarità plasmatica (Posm):
Posm = (Na+ x 2) + glicemia + urea = 280-295 mosm.l-1
se la sodiemia, la glicemia e l'azoto ureico sono espressi mmol.l-1. L'urea contribuisce poco all'osmolarità, giacché diffonde liberamente attraverso le membrane cellulari, contrariamente al glucosio. Pertanto in condizioni di normoglicemia la Posm dipende principalmente dalla sodiemia:
Posm effettiva = Na+ x 2
Il
funzionamento della pompa sodio-potassio e l'integrità della membrana
semipermeabile sono quindi indispensabili al mantenimento dell'equilibrio
osmotico. I movimenti dell'acqua e quelli del sodio risultano quindi legati tra
di loro per cui le turbe di ripartizione dell'acqua si accompagnano a quelle
del Na+.Il passaggio dell'acqua
attraverso la parete capillare è il risultato di due forze che sono
antagoniste: la pressione idrostatica (Pidro), che tende a portare fuori
l'acqua dai capillari, e la pressione oncotica (Ponc), dipendente
essenzialmente dalle proteine, che tende a trattenerla all'interno.
L'equilibrio
che si crea tra queste forze, chiamato equilibrio di GIBBS-DONNAN o legge di
STARLING, è differente a livello arterioso dove la Pidro (25 mmHg) è superiore
alla Ponc (20 mmHg) ed a livello venoso dove la Pidro (15 mmHg) è inferiore
alla Ponc (20mmHg). Al di fuori di alcune situazioni patologiche, la
proteinemia è, dunque, un buon indice dello stato di idratazione
extracellulare.
IL BILANCIO IDRICO
Attraverso un equilibrio tra entrate ed uscite dell'acqua, il volume e la composizione idroelettrolitica dell'organismo sono mantenuti a valori quasi constanti. Questo equilibrio costituisce il bilancio idrico.
|
LIQUIDO INTRACELLULARE |
|||||
| ↓ | |||||
| LIQUIDO
INTERST. 12 litri |
|||||
| ↓ | |||||
| QUOTA
ALIMENT 1.5-3 litri |
→→ | SECREZ.
INTESTINALE 8 litri |
«--------» | PLASMA 2.5 litri |
|
| ↓ |
↓ |
↓ | |||
| ↓ | PERDITE
INSENS 0.5 litri |
URINE 1-2.5 litri |
|||
| FECI 0. 1 litri |
|||||
| Bilancio idrico di un uomo di 70 Kg: valori in litri di H2O | |||||
APPORTI
PERDITE
Normalmente
uguali alle entrate possono essere suddivise in:
Urinarie
:1500-2000 ml/die variabili in relazione all'apporto e all'azione degli ormoni.
Digestive:
in condizioni normali sono poco importanti poichè le secrezioni intestinali
(circa 8 litri /die) sono riassorbite quasi totalmente. Tuttavia in seguito a
vomito, diarrea, fistole digestive le perdite digestive possono raggiungere
volumi considerevoli e condurre a importanti variazioni dell'equilibrio
idrosalino.
Polmonari,
cutanee, etc.: anche queste perdite sono trascurabili in condizioni fisiologiche
e stabili in condizioni patologiche (sudore e polipnea).
MECCANISMI REGOLATORI DEL BILANCIO IDRICO
Il
patrimonio idrico dell'organismo determina l'osmolarità dei differenti settori,
in particolare del settore plasmatico (Posm). Malgrado le fluttuazioni
giornaliere dell'apporto e delle perdite di acqua, il bilancio idrico è
mantenuto costante con una Posm che non varia oltre l'1-2%. Le perdite idriche
pure, o comunque con una prevalenza in acqua rispetto ai soluti (perdite
ipotoniche), provocano una ipertonicità plasmatica e viceversa.
Il
bilancio idrico è mantenuto in equilibrio attraverso la regolazione della
tonicità plasmatica da parte degli osmocettori. Questi hanno la duplice
capacità di controllare le perdite urinarie, grazie al potere di concentrazione
e di diluizione del rene sotto l'influenza dell'ormone antidiuretico(ADH), e di
aumentare l'apporto idrico esogeno sotto lo stimolo della sete.
CONTROLLO DELLE PERDITE URINARIE
L'ADH
o arginina-vasopressina è il solo ormone che interviene nel bilancio idrico. E'
un ormone che, sintetizzato dai nuclei paraventricolare e sopraottico
dell'ipotalamo, viene trasportato nell'ipofisi posteriore attraverso gli assoni
ipotalamo-ipofisari e immagazzinato,nella post-ipofisi da dove verrà secreto.
L'ADH è metabolizzato nel fegato e nel rene con un'emivita di 10-20 minuti.
Effetti dell'ADH
Questo
ormone gioca un ruolo determinante nell'escrezione renale di acqua,
aumentandone il riassorbimento ed incrementando così l'osmolarità urinaria.
L'ADH agisce su un recettore specifico, posto sulla membrana peritubulare
inducendo la sintesi di AMP ciclico. L'ADH permette dunque l'eliminazione di
urine la cui osmolarità si adatta a quella del plasma. Nella sindrome da
inappropriata secrezione di ADH (SIADH) si evidenzia un aumento della
osmolarità urinaria. Gli effetti extrarenali dell'ADH sono rappresentati da una
vasocostrizione arteriosa e da una diminuzione della secrezione salivare e
gastrica.
Gli
stimoli maggiori alla secrezione di ADH sono l'aumento dell'osmolarità
plasmatica ed la diminuzione del volume circolante.
Un'iperosmolarità
plasmatica comporta un aumento della sete e della secrezione di ADH. Entrambi i
meccanismi riportano rapidamente alla norma l'osmolarità. L'iposmolarità ha un
effetto inverso. Esiste una soglia ("set point"o "reset
osmostat") di 280 mosm.l-1 al di sotto della quale il tasso di
ADH è indosabile. Al di sopra di questo valore gli aumenti di Posm sono seguiti
linearmente da aumenti dell'ADH per raggiungere un massimo ad una Posm
di 295 mosm.l-1. Oltre questo valore entrano in funzione altri
meccanismi di compenso. Il valore soglia e la sensibilità degli osmocettori è
pressocchè identica in tutti i soggetti in condizioni di idratazione e di
postura identiche.
Numerosi
fattori fisiologici e patologici possono alterare questo meccanismo:
la
velocità di comparsa e di aumento dell'ipertonia plasmatica. La secrezione di
ADH a parità di Posm, aumenta in misura maggiore se la variazione di Posm è
brusca come per esempio avviene durante l'infusione di liquidi ipertonici.
il
tipo di soluto responsabile dell'ipertonia può influire in modo diverso sulla
sensibilità degli osmocettori. La stimolazione massima avviene quando
l'iperosmolarità è dovuta ad una ipernatriemia; è nulla quando si tratta di
urea (che attraversa facilmente la membrana cellulare realizzando dunque una
iperosmolarità isotonica) e di glucosio (probabilmente per lo stesso motivo).
altri
fattori, per Posm identica, possono influenzare la secrezione di ADH che
aumenta con l'età, gli estrogeni e durante la gravidanza.
la
volemia efficace: l'ADH riveste probabilmente un ruolo nella regolazione della
volemia. La sua secrezione può essere stimolata tramite i barocettori quando,
malgrado una Posm normale, la pressione arteriosa si riduce di oltre il 15%.
Tali barocettori sono presenti nell'atrio sinistro, nel bulbo aortico e nel
seno carotideo. La secrezione di ADH aumenta in maniera esponenziale in
relazione all'entità dell'ipovolemia. La quantità di ADH necessaria
per modificare la volemia è di gran lunga maggiore di quella che partecipa alla
regolazione dell'osmolarità plasmatica. Esiste, quindi, una stretta
correlazione tra gli osmo e i barocettori che stimolano l'ADH: in caso di
ipovolemia minima, la stimolazione degli osmocettori dell'ADH non viene
modificata. Quando l'ipovolemia è di maggiore entità, gli osmocettori perdono
il loro ruolo di regolazione perchè la quantità di ADH secreta è molto
importante con un'antidiuresi massima. Reciprocamente, le ipotonie maggiori
aboliscono gli effetti emodinamici delle ipovolemie moderate. Questo suggerisce
che le cellule ipotalamiche rispondono alle variazioni di volume e della
pressione osmotica.
altri fattori che modificano la secrezione di ADH sono riassunti in tabella:
| secrezione di ADH | |
|
F. stimolanti |
F.inibenti |
|
iposodiemia stress (dolore) nausea ipoglicemia ipossiemia nicotina morfina |
ipoosmolarità |
|
ipervolemia |
|
|
etanolo |
|
|
fenintoina |
|
Nel
paziente chirurgico per esempio, possono persistere tassi elevati di ADH per
diversi giorni dopo l'intervento in risposta allo stress legato al dolore. Se,
in questo periodo, viene perfusa una grande quantità d'acqua, si può verificare
ritenzione idrica con iponatriemia poichè l'ADH impedisce la fuga di acqua in
eccesso.
CONTROLLO
DELL'APPORTO ESOGENO di ACQUA: LA SETE
La
sete è una sensazione che compare quando le perdite d'acqua sono superiori
all'apporto esogeno e quando la Posm aumenta. Nell'adulto sano, la sete è
essenzialmente (ma non esclusivamente) controllata da osmocettori localizzati
nell'ipotalamo anteriore e nell'area preottica ventrolaterale, adiacenti ma
separati dagli osmocettori che controllano la secrezione di ADH. Sul piano
funzionale, le proprietà degli osmocettori che regolano la sete sono identiche
a quelle che regolano la secrezione di ADH. La loro attivazione avviene a
partire da un valore soglia di Posm uguale a 290 mosm.Kg-1: al di là
di questo valore compare la sete che diventa via via sempre più intensa. Questo
valore soglia è superiore a quello degli osmocettori che controllano la
secrezione di ADH ed è vicino al valore che determina una secrezione massima di
ADH. La sete, dunque, interviene nella regolazione della pressione osmotica
quando vengono superati i meccanismi di antidiuresi perché la produzione di ADH
ha raggiunto il suo massimo. La regolazione della Posm con la sete non ha
limiti superiori, come si può osservare nel diabete insipido in cui le perdite
di urine ipotoniche possono superare 20 litri al giorno senza comparsa di
ipertonia grazie all'apporto di una quantità d'acqua adeguata. La sete
rappresenta, quindi, Il più importante meccanismo di difesa contro un'ipertonia
plasmatica.
Gli
osmocettori della sete, così come quelli responsabili della secrezione di ADH,
sono più sensibili all'ipertonia causata da una perfusione di sali o di mannitolo
che non ad una di zucchero.
CONCLUSIONI
Il
mantenimento del bilancio idrico è garantito da una estrema stabilità della
Posm plasmatica. Questo è possibile grazie al meccanismo della sete e della
secrezione di ADH regolati dall'intermediazione di osmo e barocettori. Esiste,
comunque, una gerarchia che controlla l'azione di questi due meccanismi. Le
modificazioni della Posm agiscono sulla capacità di concentrazione diluizione
delle urine operata dal rene tramite l'ADH. L'ipoosmolarità plasmatica (iperidratazione
cellulare) inibisce la secrezione di ADH con emissione di urine ipotoniche,
riportando alla norma la Posm. Inversamente, se la Posm aumenta (disidratazione
intracellulare), viene stimolata la liberazione di ADH che determina
l'emissione di urine ipertoniche con ritenzione di acqua libera. Quando, ciò
malgrado, la Posm rimane elevata (>290 mosm.Kg-1) ed il
meccanismo dell'antidiuresi raggiunge il massimo, compare la sensazione della
sete che agisce in sinergia con l'ADH.
EQUILIBRIO DEL SODIO
IL SODIO NELL'ORGANISMO
Il
sodio totale dell'organismo in un adulto normale è di circa 60 mEq/Kg di peso
corporeo. Il 30% del Na+ totale corrisponde ad una frazione non
scambiabile, rappresentata essenzialmente dal Na+ fissato alle ossa.
Il restante 70% che possiede proprietà osmotiche, si ripartisce per l'85% nel
settore extracellulare e per il 15% in quello intracellulare. Quindi, al
contrario del potassio, che è il catione intracellulare principale, il Na+
e gli anioni cloro (Cl-) e bicarbonato (HCO3-)
rappresentano più del 90% degli elettroliti del settore extracellulare. La
concentrazione plasmatica del Na+ o natriemia e quella del settore
interstiziale sono simili, dell'ordine di 140 +/- 5 mEq/l
IL BILANCIO SODICO
In
condizioni normali, il bilancio del sodio è costituito dall'equilibrio tra le
entrate e le uscite del Na+.
Le entrate alimentari ammontano a 50-250 mmol
al giorno.
- Le perdite urinarie sono dello stesso ordine. Le perdite digestive (10 mmol/die) e quelle cutanee (10 mmol/die) sono minime. Le secrezioni intestinali sono, invece, importanti (700 mmol/die) e possono determinare, in condizioni patologiche, perdite sodiche considerevoli. Anche le perdite insensibili possono diventare importanti (sudore) e causare deplezioni del pool sodico dell'organismo.
|
LIQUIDO
INTRACELL. |
|||||||
|
↓ |
|||||||
|
QUOTA ALIMENT. |
→ |
SECREZ. INTEST. |
→ |
LIQUIDO
EXTRACELL. |
→ |
OSSO |
|
|
↓ |
↓ |
↓ |
↓ |
||||
|
↓ |
PERDITE INSENS. |
URINE |
|||||
|
FECI |
|||||||
|
Bilancio sodico (uomo sano di 70 Kg) |
|||||||
I MECCANISMI REGOLATORI DEL BILANCIO SODICO
Il
volume del settore extracellulare è determinato dal Na+ totale.
Malgrado le fluttuazioni giornaliere tra apporto e perdite di Na+,
il bilancio sodico viene mantenuto costante tramite numerosi meccanismi
regolatori.
Le
perdite sodiche dell'organismo (isosmotiche) comportano una contrazione del
settore extracellulare, mentre la somministrazione di Na+ ne
determina l'espansione. Nella maggior parte dei casi, le modificazioni del
volume extracellulare corrispondono a quelle del volume circolante plasmatico o
volemia efficace; le perdite di sodio, quindi, si traducono in un'ipovolemia e
viceversa. Nelle ustioni, nella cirrosi, nell'insufficienza cardiaca, in cui
esiste un'alterazione della permeabilità capillare, le modificazioni del
settore extracellulare si verificano in prevalenza a spese del settore
interstiziale: il carico idrosodico si traduce allora in un edema e non in
un'ipervolemia.
I
meccanismi regolatori del bilancio sodico intervengono nella regolazione del
volume plasmatico ed agiscono per l'intermediazione dei barocettori.
Il
controllo del bilancio sodico è assicurato da meccanismi detti
"afferenti" capaci di individuare le modificazioni del volume
extracellulare (VEC) e da meccanismi "efferenti" che trasmettono
l'informazione appropriata vale a dire riassorbimento o escrezione urinaria di
Na+.
MECCANISMI AFFERENTI
L'organismo
possiede diversi recettori sensibili alle variazioni del VEC e dunque alle
variazioni del capitale sodico totale. I baro- o volocettori, sensibili alle
modificazioni della volemia efficace, sono presenti a livello del settore
plasmatico e rappresentano il determinante essenziale dell'escrezione urinaria
di Na+.
Il
ruolo del compartimento interstiziale in questa regolazione è tuttora difficile
da precisare, poiché nessun recettore è stato ancora identificato;
esisterebbero comunque delle terminazioni nervose capaci di registrare le
variazioni del pool sodico interstiziale.
I
baro o volocettori
a)
Barocettori intratoracici:
essi sono già stati messi in evidenza
sperimentalmente. Ogni riduzione della pressione vascolare intratoracica
(legatura della v. cava sup.) determina una ritenzione sodica. Al contrario, un
aumento della pressione intratoracica come si verifica, per esempio, durante
un'immersione porta ad un aumento della gittata cardiaca, una caduta delle
resistenze arteriose sistemiche ed un aumento dell'escrezione sodica urinaria.
Sono stati identificati diversi recettori intratoracici: volocettori delle
pareti atriali destre, sinistre, del ventricolo destro e delle pareti capillari
polmonari.
b)
Barocettori arteriosi:
sono stati messi in evidenza sperimentalmente e sono
localizzati a livello del seno carotideo. La loro stimolazione, secondaria ad
un aumento della pressione in questo distretto, determina un incremento
dell'escrezione urinaria di Na+, malgrado una pressione di
perfusione renale costante.
c)
Baro e meccanocettori intrarenali:
l'escrezione urinaria di Na+ aumenta
contemporaneamente alla pressione di perfusione renale e si riduce quando
questa diminuisce. I barocettori sono localizzati principalmente nell'apparato
juxtaglomerulare, a livello interstiziale e sottocapsulare. Vengono attivati da
modificazioni della pressione intrarenale anche in presenza di una filtrazione
glomerulare di Na+ costante. La stimolazione di tali recettori
determina una liberazione di renina che attiva il sistema
renina-angiotensina-aldosterone conducendo ad un riassorbimento di Na+.
d)
Volocettori intracranici:
Le
variazioni del volume extracellulare si accompagnano a modificazioni della
concentrazione di sodio del LCR. In caso di contrazione del settore
extracellulare la concentrazione di Na+ del LCR si riduce
determinando una ritenzione urinaria del sodio; il contrario si verifica nel
caso di espansione. Questo fenomeno attiva degli osmocettori sensibili alle
variazioni della concentrazione di Na+ del LCR. Resta, comunque, da
chiarire il ruolo esatto dei volocettori nel controllo del bilancio sodico.
e)
Volocettori intraepatici:
sono localizzati a livello della parete vascolare
della v. porta. E', tuttora, poco chiaro il loro ruolo nella regolazione del
settore extracellulare.
Modificazioni
della composizione plasmatica
Le
variazioni della composizione plasmatica possono ugualmente influire
sull'escrezione urinaria di Na+. Il riassorbimento prossimale di
sodio è influenzato dalla proteinemia e dalla pressione oncotica plasmatica
(Ponc): ogni aumento della Ponc riduce il riassorbimento di Na+ e
viceversa. Le variazioni dell'ematocrito potrebbero modificare similmente
l'escrezione urinaria di Na+, ma questo argomento rimane ancora
controverso.
MECCANISMI EFFERENTI
Numerosi
meccanismi effettori intervengono nella regolazione dell'escrezione urinaria di
Na+, in risposta ad una modificazione del volume extracellulare.
Filtrazione glomerulare e bilancio glomerulo-tubulare
La
filtrazione glomerulare rappresenta il fattore preponderante nella regolazione
della natriuresi. Nel 1961 WARDENER ha dimostrato che la natriuresi consecutiva
ad un'espansione volemica acuta era almeno in parte indipendente dalle
modificazioni del filtrato glomerulare (FG) e della secrezione di aldosterone.
Rimane, tuttavia, difficile da dimostrare l'importanza del FG nella regolazione
della natriuresi, poiché vi intervengono altri meccanismi: fattori fisici,
ormoni, variazioni della pressione idrostatica ed oncotica periglomerulare e
peritubulare che contribuiscono a realizzare il Bilancio Glomerulo-Tubulare (BGT).
Il BGT assicura che ogni variazione del FG sia seguito da un'analoga
modificazione del riassorbimento tubulare del sodio, che impedisce grosse
perturbazioni della natriuresi.
Fattori fisici renali
a)
Il meccanismo di Starling, equilibrio tra la pressione dello spazio
interstiziale e del capillare, determina il riassorbimento di Na+
nel tubulo prossimale. Su queste pressioni esercitano un'influenza le
resistenze delle arteriole glomerulari afferenti ed efferenti, in gran parte
sotto il controllo neurormonale (sistema simpatico ed angiotensina).
b)
La distribuzione del flusso plasmatico intrarenale: i tubuli juxtaglomerulari
posseggono una capacità di riassorbimento maggiore di quella dei tubuli
superficiali. In caso di ipovolemia, si verifica una redistribuzione del flusso
plasmatico renale verso le regioni profonde juxtaglomerulari che permettono un
maggiore riassorbimento di Na+. Fisiologicamente, questi effetti
restano incerti.
c)
Il flusso midollare e sua composizione: un aumento del flusso midollare
determinerebbe una riduzione della concentrazione del liquido intramidollare e
quindi una diminuzione del riassorbimento del Na+ nel tubulo
distale.
d)
L'innervazione renale: la stimolazione nervosa renale determina un'abbassamento
della natriuresi. Esistono numerosi mediatori, sia stimolanti che inibenti, di
questo fenomeno: il FG, le prostaglandine, l'angiotensina II, le catecolamine e
naturalmente la dopamina con effetti emodinamici e natriuretici.
Fattori umorali
a)
Aldosterone
Ormone
corticosurrenale, l'aldosterone è secreto nella zona glomerulare. Viene
trasformato in metaboliti inattivi dal fegato ed, in minor misura, dal rene.
Effetti
dell'aldosterone: agisce, a livello del tubulo collettore, aumentando il
riassorbimento del Na+ e del Cl- e la secrezione di K+
e di H+. Il suo inizio d'azione è di 90 minuti. Insieme al FG,
l'aldosterone realizza il più importante meccanismo di controllo del bilancio
sodico. La sua secrezione è inversamente proporzionale alla somministrazione di
Na+, ma il meccanismo intimo che conduce al riassorbimento di Na+
non è tuttora ben conosciuto ed è stato oggetto di numerose ipotesi: aumento
dell'ATP, incremento dell'attività della pompa Na-K ATPasi dipendente,
modificazione della permeabilità della membrana al Na+ o al K+.
Un
iperaldosteronismo non si accompagna necessariamente ad un'anomalia del
bilancio sodico. Nell'iperaldosteronismo primario, se nei primi giorni si
assiste ad una ritenzione urinaria di Na+, la natriuresi riprende
rapidamente anche se il tasso di aldosterone rimane elevato, permettendo così
il mantenimento di una volemia normale. Nelle insufficienze surrenali,
similmente, il riassorbimento urinario di Na+ si normalizza in
qualche giorno. Questo fenomeno chiamato " sottrazione
all'aldosterone" mostra che esistono altri meccanismi che partecipano alla
regolazione del bilancio sodico, indipendenti dal Sistema
Renina-Angiotensina-Aldosterone (SRAA), e che vengono attivati quando la
liberazione di aldosterone non è più adatta alla volemia.
Controllo
della secrezione di aldosterone:
La
secrezione di aldosterone è stimolata dall'angiotensina II, ormone
polipeptidico di origine epatica, a sua volta stimolato dalla renina: questi
ormoni costituiscono il sistema renina-angiotensina-aldosterone (SRAA) la cui
attivazione è inversamente proporzionale alla volemia ed al contenuto di Na+.
La
kaliemia (variazioni da 0.1 a 0.2 mmol/l) è uno stimolo molto sensibile della
secrezione di aldosterone; anche l'ACTH e l'iponatriemia rappresentano fattori
stimolanti la secrezione di aldosterone.
b)
Angiotensina II
Interviene
nel controllo del bilancio sodico, indipendentemente dall'effetto stimolante
sulla secrezione di aldosterone. E' dotata di proprietà vasocostrittrici e può,
quindi, modificare la volemia efficace. Infine, l'angiotensina II agisce in
maniera specifica sulle resistenze delle arteriole afferenti glomerulari.
Aumenta il riassorbimento urinario di Na+ nel tubulo contorto
prossimale sia direttamente in caso di ipovolemia, sia tramite variazioni delle
forze di Starling capillari peritubulari.
c)
Prostaglandine - Prostacicline
Vengono
sintetizzate, a livello renale, dall'endotelio glomerulare e vascolare, dai
tubuli collettori e dalle cellule interstiziali midollari. Quest'ultime
producono la PGE2, metabolita primario, mentre la corticale sintetizza le PGI2
(prostacicline) e le PGF2.
Gli effetti intrarenali hanno una grande importanza clinica soprattutto per il loro possibile potenziamento con i farmaci antinfiammatori non steroidei (FANS).
|
Effetti delle prostaglandine |
Complicazioni potenziali con i FANS |
|
Mantenimento FPR ed FG antagonizzando gli effetti vasocostrittori di angiotensina II e noradrenalina. |
Ischemia ed insuff. renale in condizioni di > angiotensina II e /o noradrenalina (cirrosi, insuff. cardiaca, s. nefrosica, ipovolemia. |
|
Aumento secrezione renina |
IperK+ dovuto ad iperaldosteronismo iporeninemico. |
|
Antagonismo effetti dell'ADH sulla permeabilità all'acqua. |
Potenzia effetti ADH. Non sono riportati ritenzione idrica ed ipoNa+, forse per iniziale ritenzione di acqua che riduce la secrezione di ADH. |
|
Possibile aumento dell'escrezione di sodio in condizioni ipovolemiche |
Possibile ritenzione idrica in stati edematosi |
d)
Ormoni natriuretici
Un'espansione
del volume extracellulare associato ad un sovraccarico di Na+
determina un aumento della natriuresi.
Responsabile
di questo fenomeno è l'associazione di fattori emodinamici intrarenali e degli
ormoni natriuretici.
Il
primo ormone natriuretico isolato è stato quello secreto nell'atrio destro per
distensione delle sue pareti. Esso agisce a livello del tubulo distale dei
nefroni corticali ed inibisce il riassorbimento del Na+ a questo
livello. Altri ormoni natriuretici come il fattore "digossina-like"
sono stati messi in evidenza, ma la loro importanza fisiologica non è ancora chiara
e resta ancora da precisare il loro ruolo nel controllo giornaliero del
bilancio sodico.
e)
Sistema Chinina-Callicreina
Le
chinine renali possono aumentare l'escrezione urinaria di Na+ per i
loro effetti vasodilatatori renali. Esse stimolano anche la sintesi di
prostaglandine e di renina. L'importanza di questi sistemi non è stata ancora
definita.
In
conclusione: la regolazione del bilancio idrico avviene tramite il mantenimento
di una osmolarità plasmatica costante. Questo equilibrio risulta dal rilevamento
delle variazioni della Posm da parte degli osmocettori. Di questi ultimi ne
esistono due tipi: quelli che stimolano la secrezione di ADH, responsabili di
una contrazione della diuresi con produzione di urine ipertoniche, e quelli che
stimolano la sete permettendo un apporto di acqua esogeno. Un bilancio idrico
negativo determina un aumento della Posm che stimola, in un primo tempo, la
secrezione di ADH. Ma raggiunto un tasso massimo di ADH e persistendo una Posm
> di 295 mosm/Kg, compare il fenomeno della sete che non presenta limiti. Al
contrario, quando il bilancio idrico è positivo, la Posm cade e viene inibita
la secrezione di ADH.
La
regolazione del bilancio sodico è legata al mantenimento di una volemia
efficace. I meccanismi regolatori di questo bilancio entrano in gioco nelle
perturbazioni emodinamiche e volemiche segnalate dai baro e volocettori. Questi
recettori realizzano i meccanismi afferenti dell'informazione che avvengono
soprattutto per via dei volocettori intratoracici ed i barocettori arteriosi ed
intrarenali. Il messaggio rilevato una volta trasmesso permette la messa in
opera dei meccanismi efferenti che modulano la secrezione urinaria di Na+:
il più importante, anche se ne esistono altri, è il SRAA. Quando la volemia
efficace si riduce a causa di un bilancio sodico negativo, i barocettori
determinano una stimolazione del SRAA con ritenzione urinaria di Na+
che permette il ristabilirsi della volemia. Inversamente, un bilancio sodico
negativo ne causa lo spostamento dal settore extracellulare con inibizione del
SRAA ed aumento della natriuresi. Nel caso di importanti variazioni
emodinamiche, l'ADH e la sete possono intervenire nel mantenimento della
volemia, non per l'intermediazione degli osmocettori, ma tramite i recettori
emodinamici.
BIBLIOGRAFIA
KOKKO
JP, TANNER RL. Fluids and eletrolytes,
Philadelphia, WB Saunders company, 1986, 870 pages.
MAXWELL MH, KLEEMAN CR, NARINS RG. Clinical disorders
of fluid and electrolyte metabolism, 4e Ed, New York, 1987, 1368 pages.
ROSE BD. Clinical physiology of acid-base and
electrolyte disorders, 2e Ed, New York, Mac Graw-Hill Book company, 1984, 702
pages.
TWEEDLE DEF. Electrolyte disorders in the surgical patient. Clin Endocrinol Metab, 1984, 13: 351-376