

ISSN 1080-3521
EDUCATIONAL SYNOPSES IN ANESTHESIOLOGY
and
CRITICAL CARE MEDICINE - Italia -
|
|
Copyright (C) 1997 Educational Synopses in Anesthesiology and Critical Care Medicine. All rights reserved. Questo rivista on-line può essere copiata e distribuita liberamente curando che venga distribuita integralmente, e che siano riportati fedelmente tutti gli autori ed il comitato editoriale. Informazioni sulla rivista sono riportate alla fine | |
In questo numero:
1 INSUFFICIENZA RENALE ACUTA IN TERAPIA INTENSIVA
2 L'INTOSSICAZIONE DEL MESE: INGESTIONE DI CAUSTICI
3 MANUALI DI ANESTESIA: BLOCCHI PERIFERICI - 1^ PARTE
_______________________________________________________
1 INSUFFICIENZA RENALE ACUTA IN TERAPIA INTENSIVA
________________________________________________________
Andrea De Gasperi
II Servizio Anestesia
e Rianimazione, Centro Trapianti
Ospedale Niguarda Cà Grande - Milano
Introduzione
L'insufficienza renale acuta costituisce tuttora una delle complicanze di maggiore rilievo e di più rilevante impatto su morbilità e mortalità dei pazienti trattati in ambiente intensivo (Shaefer et al,1991). Tale condizione è peraltro presente, in vario grado, in circa il 5% di tutti i pazienti ospedalizzati, essendo complicanza di frequente riscontro sia in corso di patologia primaria cardiaca o respiratoria (40%) che nel primo postoperatorio di interventi di chirurgia maggiore (60%) (Anderson et al,1988).
L'insufficienza renale costituisce inoltre una delle complicanze più temute in corso di sepsi, di cui è spesso una espressione iniziale che precede la sintomatologia clinica conclamatata (Muthers,1992).
Nonostante i miglioramenti nel trattamento,
che include, oltre al supporto farmacologico, tecniche sempre
più sofisticate di depurazione extracorporea continua,
l'insufficienza renale acuta presenta ancora oggi una mortalità
elevatissima (40-60 %) (Rasmussen e Ibels, 1982; Corwin e Bonventre,1988;
Shaefer et al,1991).
Definizione
Per insufficienza renale acuta (IRA) si intende una sindrome in cui la rapida compromissione della funzione renale (riduzione della filtrazione glomerulare) è associata sia alla perdita della capacità di regolazione dell'omeostasi idro-elettrolitica che alla incapacità ad eliminare cataboliti azotati (Corwin e Bonventre,1988). E' caratterizzata dall'aumento della creatininemia oltre i 2 mg dl-1 e dall'accumulo, a livello ematico, di prodotti di degradazione azotati (iperazotemia) (Lins et al,1988 ;Anderson et al,1988). La sindrome, di solito reversibile, può presentarsi come oligurica (diuresi giornaliera inferiore a 500 ml/die) oppure non-oligurica e riconoscere come cause (Anderson et al,1988; Corwin e Bonventre,1988;Lins et al,1988;Muthers et al,1992):
1. la temporanea riduzione della perfusione renale (insufficienza renale prerenale da ipoperfusione, IRP), secondaria a grave deplezione volemica o a riduzione critica del volume circolante
2. una patologia intrinseca a carico del parenchima renale (strutture glomerulari, tubulari, interstiziali, vascolari), oppure una alterazione della emodinamica intrarenale (insufficienza renale intrinseca). In questa categoria sono di solito incluse la tossicità da farmaci e le reazioni su base allergico-iperergica in grado di provocare un danno tubulare (necrosi tubulare acuta, NTA)
3. una ostruzione al flusso urinario
(insufficienza renale postrenale da uropatia ostruttiva)
Tralasciando il problema ostruttivo, certamente di minore rilievo in Terapia Intensiva, le condizioni elencate ai punti 1. e 2. costituiscono di gran lunga le cause più frequenti di IRA nel paziente critico.
L'interpretazione della riduzione della
filtrazione glomerulare che si osserva in corso di sofferenza
ischemica o tossica presenta ancora aspetti non chiariti. Appaiono
tuttavia rilevanti (Corwin e Bonventre,1988; Stevens et al,1990):
1. la ostruzione tubulare determinata dalla presenza di detriti cellulari in grado di aumentare la pressione intraluminale e di ridurre la pressione di filtrazione: questo meccanismo è importante nelle forme ischemiche
2. la presenza di diffusione per via retrograda di filtrato glomerulare (backleak filtrate theory), legate a discontinuazioni o danneggiamento dell'epitelio tubulare : tale teoria,ben dimostrata nel modello sperimentale animale,non sembra però avere rilevanza clinica nell'uomo
3. la riduzione della perfusione renale per alterazioni della emodinamica sistemica o locale: tale condizione, comune a tutte le forme di IRA, è responsabile della riduzione della pressione di filtrazione glomerulare per aumento della vasocostrizione delle arteriole renali afferenti e per concomitante vasodilatazione delle arteriole renali efferenti (situazione peraltro dimostrata in corso di sepsi e legata alla presenza di mediatori). Si ipotizza inoltre un ruolo del sistema renina-angiotensina e di mediatori quali prostaglandine e tromboxani e la formazione di edema a carico delle cellule endoteliali: quest'ultimo meccanismo è responsabile dell'aumento delle resistenze vascolari renali e della riduzione del flusso ematico
4. alterazione della permeabilità
glomerulare, quale si può osservare ad esempio in corso
di nefrotossicità da aminoglicosidi, condizione in grado
di alterare il coefficiente di ultrafiltrazione (Kf)
Appare dunque evidente come l'insulto ischemico (per alterazione intrinseca della emodinamica renale oppure secondario a ridotta perfusione) costituisca una causa comune a molte delle condizioni sopra ricordate ed in grado di portare a IRA.
Le ipotensioni prolungate secondarie a grave ipovolemia (emorragie rapide ed imponenti), a deficit della funzione cardiaca (shock cardiogeno, shock settico), a manovre che interrompano o siano comunque in grado di interferire con la circolazione renale (manipolazione viscerale in corso di interventi di chirurgia generale, clampaggio aortico in corso di chirurgia cardica o vascolare maggiore) costituiscono le cause di più comune osservazione
Oltre a tali condizioni, di solito definite come postischemiche, deve essere ricordata la possibile tossicità da sostanze o agenti nefrotossici quali aminoglicosidi, amfotericina B, ciclosporina, mezzi di contrasto iodato, anestetici volatili (metossifluorano ed in minore misura l'enflurano), in grado di determinare di per sè danni di tipo ischemico a carico del rene. Nel caso dei mezzi di contrasto radiografici, accanto a fattori predisponenti come la preesistente condizione di insufficienza renale, la disidratazione, la presenza di diabete mellito o di mieloma multiplo e/o di ipoalbuminemia (Muthers et al,1992) si deve pensare ad una genesi multifattoriale sostenuta da tossicità diretta, ostruzione tubulare, alterazione della emodinamica renale con vasodilatazione transitoria seguita da vasocostrizione prolungata. Quest'ultima condizione è probabilmente mediata da adenosina generata a livello tubulare e da aumento del calcio intracellulare (Muthers et al,1992).
Gli aminoglicosidi sono responsabili del 5% di tutte le insufficienze renali intraospedaliere: questi antibiotici vengono eliminati per il 90% (Hou et al,1983 in Muthers,1992) per via renale per filtrazione glomerulare. Una volta filtrate, queste sostanze sono riassorbite e concentrate a livello lisosomiale nelle cellule tubulari prossimali. Sebbene il preciso meccanismo di tossicità non sia perfettamente conosciuto, si ritiene che danno mitocondriale, distruzione della membrana cellulare ed attivazione di enzimi lisosomiali svolgano comunque un ruolo rilevante: vasocostrizione e riduzione del gradiente di ultrafiltrazione contribuiscono a mantenere la tossicità. La forma di solito si presenta come non-oligurica o poliurica, si associa a trattamenti di 7 - 10 giorni, necessita di 1-2 settimane per la guarigione che di solito è completa (Muthers,1992)
Sebbene di per sè non direttamente nefrotossiche, rilevanti quantità di mioglobina derivanti da rabdomiolisi secondaria a trauma (crash syndrome), ischemia (insufficienza arteriosa acuta), agenti fisici (colpo di calore, esercizio fisico violento, ipertermia maligna o secondaria a neurolettici) o alterazioni metaboliche (ipopotassemia, ipofosfatemia) possono depositarsi per precipitazione a livello tubulare, determinare la formazione di cilindri e provocare la ostruzione tubulare acuta. Analogo meccanismo è ipotizzato per la insufficienza renale acuta secondaria a emolisi intravascolare (reazione da trasfusione eterologa), in cui responsabile della ipoperfusione renale è la precipitazione di sostanze tossiche derivanti dallo stroma dei globuli rossi ( Muthers,1992).
Come già ricordato, la sepsi costituisce una delle cause più frequenti di insufficienza renale acuta e di MODS (Multiple organs disfunction) in Terapia Intensiva e comunque nel paziente critico: la riduzione del flusso plasmatico renale e della filtrazione glomerulare dipendono in questo caso dalla simultanea alterazione della emodinamica sistemica (vasodilatazione da caduta di resistenze sistemiche) ed intrarenale (aumento delle resistenze vascolari renali). Le modificazioni emodinamiche appaiono legate alla presenza di endotossine, esotossine, o mediatori quali interleuchina 1 (IL1) , tumor necrosis factor (aTNF) o tromboxano A2.(Rayner et al,1990). Queste sostanze sono fra l'altro responsabili delle alterazioni che, in assenza di sepsi franca (febbre, tachicardia, ipotensione), possono essere presenti in questi pazienti (trombocitopenia, alterazione dello stato di coscienza, alterazione dei tests di funzione epatica, acidosi metabolica)
L'insulto ischemico a carico del rene,
in cui la formazione di radicali liberi gioca certamente un ruolo
importante, colpisce in particolare la zona midollare più
esterna, dove la sofferenza ipossica è maggiore. In effetti,
importante sofferenza è rilevabile a carico del tratto
ascendente dell'ansa di Henle, responsabile del riassorbimento
di sodio e cloro, la cui perdita costituisce un segno riconosciuto
di sofferenza tubulare. Il flusso renale, inizialmente ridotto,
riprende di solito entro 24 ore dall'insulto acuto, mentre più
prolungata è la riduzione del filtrato glomerulare: fattori
che certamente contribuiscono al mantenimento della depressa filtrazione
sono la vasocostrizione preglomerulare, la riduzione di Kf e la
perdita per via retrograda di ultrafiltrato. In effetti nella
fase di ripristino funzionale un ruolo importante è giocato
da prostaglandine, fattori di crescita e free radicals scavengers.
Diagnosi e diagnostica differenziale
La diagnostica differenziale deve prevedere
come primo passo la differenziazione tra cause prenali, intrarenali
od ostruttive: all'interno delle varie sindromi si delineerà
poi la specifica eziologia.
Storia clinica ed esame obbiettivo
Appare fondamentale disporre di una
anamnesi patologica che comprenda, oltre alla definizione di preesistenti
malattie a carico dell'apparato renale, precedenti patologie cardiovascolari
(ipertensione arteriosa, insufficienza cardiaca congestizia, pericarditi,
vasculiti), tumorali o sistemiche (concomitante patologia epatica)
e l'eventuale uso di farmaci . La definizione dello stato volemico
del paziente e dell'effettivo volume circolante appare di fondamentale
importanza e richiede in molti casi, oltre all'esame obbiettivo,
anche il supporto di indagini invasive (incannulamento di vena
centrale e misura della pressione venosa centrale o addirittura
cateterismo cardiaco destro con catetere di Swan Ganz e misurazione
della pressione polmonare di incuneamento ). Tali parametri, che
consentono una corretta definizione del precarico, appaiono giustificate
da una parte dalla necessità di differenziare le forme
di IRP da quelle intraparenchimali (NTA), dall'altra di eseguire
un trattamento in qualche caso eziologico e non solo sintomatico
(Corwin e Bonventre,1988) .
Esame delle urine
Dati fondamentali da ricercare per la diagnostica differenziale sono la presenza di ematuria e di proteinuria: la proteinura è di solito associata a danno glomerulare. Ad un test semiquantitativo positivo (dipstick), deve seguire un dosaggio della proteinuria giornaliera. La perdita superiore a 3 gr/die è in effetti di solito legata ad un danno glomerulare.
L'esame microscopico del sedimento può
costituire un importante mezzo di orientamento diagnostico. In
effetti la NTA è frequentemente associata alla presenza
nel sedimento urinario di cilindri granulari o granulo epiteliali
pigmentati, di cellule dell'epitelio tubulare, di conglomerati
di detriti cellulari . Cilindri composti da conglomerati di globuli
rossi o la presenza di un elevato numero di globuli rossi depone
di solito per lesioni glomerulari, mentre cilindri composti da
globuli bianchi oppure la elevata presenza di elementi cellulari
della serie bianca depongono per un danno renale interstiziale
(Corwin e Bonventre,1988).
Concentrazione elettrolitica nelle urine ed indici diagnostici
Sodio - La eliminazione renale del sodio, governata dal sistema renina -angiotensina -aldosterone e probabilmente dall'ormone natriuretico atriale, è regolata in modo da mantenere un volume circolante efficace (Rose,1989). La sua concentrazione urinaria può pertanto essere utilizzata per quantificare lo stato volemico del paziente, ritenendosi una concentrazione inferiore a 15 mEq/l indice di un grave stato ipovolemico. La concentrazione urinaria di sodio, normalmente riassorbito per circa il 90% a livello di tubulo prossimale e distale, riflette pertanto la capacità di riassorbimento del sodio filtrato. In presenza di ipoperfusione renale e con mantenuta funzione tubulare (come in caso di IRP) si osserva una marcata contrazione della eliminazione urinaria di sodio ( in assenza di diuretico anche al di sotto dei 20 mEq/l). Al contrario in presenza di NTA si osserva una eliminazione urinaria di sodio superiore a 30 - 40 mEq/l.
Valori di sodio urinario compresi fra
20 e 30 mEq/l presenti sia in caso di IRP che in corso di NTA
rendono necessari per la diagnosi differenziale il calcolo della
escrezione frazionale del sodio (percentuale del sodio filtrato
escreto nelle urine, FENa%) utilizzando la formula
In corso di IRP a funzione tubulare conservata, quindi con un importante stimolo a riassorbire sodio, la FE Na è di solito compresa tra 1 e 2%, mentre in presenza di NTA il valore è superiore a 3-4%. Il test, se applicato correttamente, può contribuire alla diagnosi differenziale nel 90% dei casi (Rose,1989).
Esistono però alcune eccezioni che devono tenute presenti quando si interpreti questo test. In corso di trattamento diuretico (furosemide o mannitolo) o di diuresi osmotica anche in presenza di IRP la FE Na può essere superiore a 3%; condizioni di solito associate ad aumento del riassorbimento del sodio (insufficienza cardiaca congestizia, ascite) possono determinare FE Na erroneamente molto basse in caso di NTA (Corwin e Bonventre,1988;Muthers,1992). Sepsi, NTA da mezzo di contrasto o da rabdomiolisi possono essere associate a bassa FE Na.
Deve infine essere ricordato come pazienti
portatori di NTA non oligurica abbiano frequentemente valori di
FE Na intermedi tra quelli osservati in corso di IRP e NTA oligurica
(Diamond et al,1982 in Muthers,1992).
Cloro
- La escrezione urinaria di cloro è di solito simile a
quella del sodio. Tuttavia in condizioni di ipovolemia
è frequente osservare una riduzione della eliminazione
del cloro ed una differenza tra sodio e cloro urinario di
più di 15 mEq/l (Sherman e Eisinger,1982) : questo è
comune in casi di alcalosi metabolica secondaria ad ipovolemia,
condizione nella quale l'equilibrio acido base tende ad essere
mantenuto grazie all'aumento della eliminazione di HCO3 - come
NaHCO3 -. Una grave ipovolemia manterrà però lo
stimolo alla ritenzione sodica e pertanto la persistenza della
alcalosi per ridotta eliminazione di Na e HCO3-. Pertanto in caso
di IRP (a cui è di solito associata alcalosi metabolica
per la presenza di ipovolemia) sarà costante la presenza
di cloro urinario basso (20 - 30 mEq/l): Anderson indica in effetti
la cloruria come un parametro più specifico e sensibile
del sodio urinario per la differenziazione tra IRP e NTA (Anderson
e Schrier,1988;Rose,1989). Unica possibilità di alterare
questo profilo è l'utilizzo di diuretici : in tal caso
la concentrazione urinaria assoluta del cloro sarà più
elevata, ma sarà sempre presente una differenza importante
con il sodio.
Potassio
- L'escrezione di potassio varia con l'assunzione giornaliera
e tale risposta è regolata dalla concentrazione plasmatica
di K+ e dall'aldosterone: la escrezione abituale è di circa
20 mEq/l, ritenendosi una perdita superiore a 25 mEq/l legata
a perdita tubulare. Una condizione di iperkaliemia è costante
in caso di insufficienza renale ed è determinata dalla
inappropriata eliminazione renale.
Osmolarità urinaria - I soluti contenuti all'interno di una soluzione generano una pressione (pressione osmotica) proporzionale al numero di particelle per unità di volume di solvente (ed indipendente da valenza o peso): unità di misura della pressione osmotica è la osmole (pari al peso molecolare della sostanza espresso in grammi) .Per osmolalità si intende quindi il numero di osmoli per kilogrammo di acqua (mosmol/Kg): il volume totale sarà pertanto composto da un litro di acqua più il piccolo volume occupato dai soluti. Il termine è spesso confuso con osmolarità (osmoli per litro di soluzione), peraltro con differenza trascurabile. La concentrazione di soluti in una soluzione può anche essere valutata con la misura della gravità specifica (peso della soluzione confrontato con quello di un volume uguale di acqua distillata). La gravità specifica è proporzionale al peso delle molecole di soluto: con urina normale ad esempio, il valore della gravità specifica rappresenta in maniera soddisfacente la osmolalità: in presenza invece di grosse molecole in elevata concentrazione (glucosio, mannitolo, mezzi di contrasto radiologici), si osserverà un grosso aumento della gravità specifica rispetto alla osmolalità.
L'osmolalità urinaria (n = 400
- 1100 mosm/kg) gioca un ruolo chiave nella regolazione della
osmolalità plasmatica (n= 280 - 310 mosm/kg), e della concentrazione
ematica del sodio. Questa risposta è mediata dagli osmorecettori
ipotalamici che influenzano sete e secrezione di ADH e comportano
complesse interrelazioni sia con la funzione tubulare a vari livelli
del nefrone, che con il flusso ematico renale. La capacità
di produrre urina concentrata richiede pertanto capacità
di concentrazione urinaria conservata e funzione tubulare intatta.
In questo senso il monitoraggio della osmolalità urinaria
(misurata direttamente) , in aggiunta al calcolo della frazione
di escrezione del sodio, può essere utile nella diagnosi
differenziale tra IRP e NTA postischemica come causa di IRA. In
effetti in entrambe le condizioni può essere presente stimolazione
alla produzione di ADH per la presenza di ipovolemia relativa.
Tuttavia per la presenza di danno tubulare, in corso di NTA si
avrà la escrezione di urine con osmolarità inferiore
a 400 mosm/kg, mentre in caso di IRP determinata da ipovolemia
ed in assenza di danno tubulare, si osserverà osmolalità
superiore a 600 mosm/kg. La elevata osmolalità porta quindi
alla diagnosi di esclusione di NTA: il riscontro di urina isoosmotica
invece è di solito legato a patologia intraparenchimale,
ma non permette di escludere una componente ipovolemica in soggetti
anziani, in pazienti con grave riduzione della filtrazione glomerulare,
in presenza di compromissione della capacità di concentrazione,
come si osserva in soggetti trattati con diuretici (Rose,1989).
Indici e parametri calcolati (Corwin e Bonventre,1988)
Dati diretti ed indici sono di estremo
interesse nella diagnosi differenziale delle varie condizioni
di insufficienza. Deve tuttavia esserne ricordato il limite, costituito
da precedente patologia renale o da concomitante utilizzo di diuretici,
condizioni entrambe in grado di alterare escrezione urinaria degli
elettroliti e capacità di concentrazione renale.
1) Uosm/Posm
Un parametro calcolato utile per differenziare la NTA da IRP è il rapporto Uosm/Posm , in corso di NTA vicino a 1, superiore a 1.2 in caso di IRP .
2) Ucreat / Pcreat
La concentrazione della creatinina urinaria riflette la quantità di acqua riassorbita a livello tubulare : rapporti elevati (superiori a 40) sono correlati a IRP, mentre un rapporto inferiore a 20 è di solito correlato ad un difetto di riassorbimento di acqua a livello tubulare (Miller TJ et al,Ann Int Med,1978 in Corwin e Bonventre,1988)
3) Uurea/Purea
In presenza di ipovolemia reni normalmente funzionanti sono in grado di eliminare in piccoli volumi di urina elevate quantità di urea, al contrario di quanto invece si osserva in presenza di danno tubulare. In caso di IRP il rapporto è superiore a 8, mentre in presenza di NTA il rapporto è inferiore a 3 (Miller TJ et al,Ann Int Med,1978 in Corwin e Bonventre,1988)
4) P BUN/ Pcreat
Un rapporto superiore a 20 è
di solito presente in caso di IRP, mentre la NTA è associata
a valori inferiori a 10. Tali valori sono tuttavia spesso alterati
da fattori di ordine metabolico in grado di aumentare il valore
di BUN (terapia steroidea, catabolismo, sanguinamento del tratto
GE) o di ridurre il valore di creatininemia (età, massa
muscolare) in assenza di modificazioni effettive del volume circolante
.
5) Renal failure Index (RFI)
Costituisce una formula che ingloba
il sodio urinario ed il rapporto creatinina urinaria/creatinina
sierica : valori inferiori all'1% sono suggestivi di insufficienza
renale prerenale.
Altre procedure diagnostiche
Indagini radiologiche
L'interesse principale di queste metodiche risiede nella possibilità di definire lesioni renali traumatiche (accertate o sospette) od ostruttive: poichè l'utilizzo del mezzo di contrasto introduce la possibilità di indurre o peggiorare la insufficienza renale, il rischio potenziale deve essere controbilanciato dalla utilità delle informazioni ottenibili.
L'urografia per via endovenosa , se
normale, esclude lesioni traumatiche renali, ma in caso di reperto
patologico devono necessariamente essere eseguite TAC (utile oltre
che per traumi per la definizione di masse renali e spesso preferita
alla arteriografia ) o arteriografia (di cui oggi si utilizza
sempre più frequentemente la tecnica con sottrazione digitale)
.
Tecniche ultrasonografiche
E' di sempre maggiore utilizzo la tecnica
ultrasonografica, in grado di fornire, con tecnica non invasiva
e priva di rischi, informazioni di tipo morfologico e pertanto
fondamentali nella definizione di fenomeni ostruttivi (Corwin
e Bonventre,1988). Di recente è stato proposto l'uso dell'ecodoppler
per studiare in modo attendibile, riproducibile e non invasivo
le caratteristiche del flusso ematico a livello dell'arteria renale
interlobare in soggetti con insufficienza renale acuta (Stevens
et Coll,1990): la morfologia dello spettro Doppler in questi soggetti
subisce una importante modificazione rispetto allo spettro normale
(riduzione o perdita della fase diastolica) e diviene pertanto
diagnostica nella IRA. Nello studio proposto da Stevens e Coll
(1990) tali modificazioni erano particolarmente evidenti in IRA
in corso di sepsi , consentivano la valutazioni della appropriatezza
e della efficacia degli interventi terapeutici (farmacologici
e non) e permettevano la previsione del recupero funzionale .
Radionefrogramma
Questa tecnica è utilizzata per
documentare la perfusione vascolare e trova importanti applicazioni
in campo trapiantologico. Ha invece limitate indicazioni in caso
di IRA o di NTA (dove fra l'altro per la semplicità di
esecuzione sta per esseer soppiantata dall'EcoDoppler) (Stevens
et Coll,1990)
La prevenzione ed il trattamento farmacologico della insufficienza renale acuta
In modelli sperimentali i danni determinati
da insulti ischemici erano limitati o addirittura prevenuti dal
pretrattamento con mannitolo (Burke et al,1980). L'effetto protettivo
è certamente legato a più di un fattore, essendo
stati proposti come possibili meccanismi il free radicals scavenging,
la produzione di prostaglandine ad azione vasodilatatrice, la
riduzione dell'edema cellulare, la prevenzione della ostruzione
tubulare (Brezis et al,1991). Da un punto di vista clinico i risultati
sono stati tuttavia contrastanti e comunque non consentono conclusioni
definitive. Appare probabile un effetto positivo in presenza di
emoglobinuria o di mioglobinuria, in caso di IRA da mezzo di contrasto
o di nefrotossicità da amfotericina B o da cisplatino (Corwin
e Bonventre,1988). Non confermati da studi sufficientemente ampi
e soprattutto prospettici sono i risultati positivi ottenuti in
presenza di clampaggio della arteria renale o della aorta sottorenale,
in corso di chirurgia epatica maggiore o di interventi di chirurgia
cardiaca (Brezis et al,1991). L'utilizzazione di diuretici dell'ansa
ad alte dosi (2-3 grammi/die) nella insufficienza renale acuta
nell'uomo è tuttora oggetto di controversie (Brezis et
al,1991). Nella insufficienza renale terminale la risposta alla
somministrazione di furosemide ad alte dosi appare legata alla
possibilità di escrezione della sostanza a livello tubulare,
meccanismo che consente il blocco del riassorbimento elettrolitico
(prima del Cl e quindi del Na e dell'acqua) a livello dell'ansa
di Henle e la conseguente risposta diuretica (Van Olden et Coll,1995).
E' verosimile ottenere una riduzione del dosaggio totale a parità
di risposta diuretica utilizzando la furosemide in infusione continua
(0.25-0.75 mg kg-1 ora-1 )(Krasna et Coll,1986). Se è probabile
che si ottenga un maggiore volume urinario, è però
verosimile che non si modifichi il FG. Non ha ricevuto invece
conferme l'effetto di vasodilatazione renale in presenza di dopamina
a dosi comprese tra 1 e 3 g kg-1 min-1: l'aumento significativo
della diuresi si otteneva in effetti solo in associazione a furosemide.
Conferme in questo senso sono venute anche da Gunning in corso
di trapianto di fegato.
La terapia sostitutiva per insufficienza renale acuta in ambiente intensivo
Le indicazioni al trattamento sostitutivo sono costituite dalla insufficienza renale acuta, dai pazienti in trattamento dialitico cronico (emodialisi, dialisi peritoneale) che necessitino ricovero in TI, dalla correzione di sovraccarichi idrici (in ambito internistico oppure chirurgico sia nel periodo pre che postoperatorio), dalla correzione di particolari condizioni metaboliche (iperkaliemia, iponatremia), da alcune intossicazioni (Bartok e Hilton,1993).
La terapia dialitica convenzionale (emodialisi intermittente o dialisi peritoneale) trova sempre meno frequentemente indicazione in ambiente intensivo: le tecniche di sostituzione continua (emofiltrazione continua arterovenosa o venovenosa, quest'ultima con utilizzo di pompa peristaltica) offrono al contrario consistenti vantaggi sia per la rimozione di cataboliti azotati che per la gestione del bilancio fluidico e nutrizionale in pazienti spesso instabili dal punto di vista emodinamico e che possono male tollerare la emodialisi intermittente (Baudouin et Coll,1993).
In effetti sebbene simili, le due tecniche (emodialisi ed emofiltrazione) sono assai differenti.
Nella tecnica emodialitica intermittente (emodialisi convenzionale) sangue e soluzione dialitica fluiscono in opposte direzioni nel rene artificiale, separati da una membrana semipermeabile: la rimozione dei soluti avviene per diffusione secondo gradiente di concentrazione tra sangue e dialisato (meccanismo diffusivo). Si ottiene facilmente il passaggio di molecole di piccole dimensioni (200 Daltons) a seconda della velocità del flusso ematico o del dialisato. Il passaggio di molecole di maggiori dimensioni è invece regolato dal peso molecolare e dalle caratteristiche delle membrane.
Nella emofiltrazione il sangue è pompato attraverso una membrana ad elevata permeabilità ed il gradiente di pressione attraverso la membrana determina il passaggio di acqua e di molecole fino a 20 kDa con meccanismo analogo alla filtrazione glomerulare (meccanismo convettivo): l'ultrafiltrato cosi' prodotto è rimpiazzato con soluzioni isotoniche La frazione di plasma filtrato (di solito compresa tra 10 e 30%) dipende dalla pressione osmotica, dalla pressione idrostatica transmembrana e dalla superficie e dalla permeabilità della membrana. Una buona efficienza della filtrazione si raggiunge di solito con elevati flussi (150 ml/min) pur con frazioni di filtrazioni comprese tra il 15 ed 20%: questo evita la eccessiva emoconcentrazione e la possibilità di coagulazione dei filtri (Barton e Hilton,1993). Il meccanismo convettivo offre inoltre la possibilità di rimozione dal circolo di antibiotici (vancomicina), sostanze ad elevato peso molecolare (mediomolecole), mediatori dello stato settico (citokine proinfiammatorie quali TNF, IL1) che non vengono rimossi con le metodiche convenzionali intermittenti basate sulla diffusione, e potrebbe aggiungere nuove ed interessanti possibilità terapeutiche nel paziente settico con insufficienza multipla di organo : sebbene siano già dimostrati effetti positivi sulla funzione ventricolare destra e sinistra e sulla funzione polmonare (Bellomo,1994), deve tuttavia essere sottolineato come nessun studio controllato o prospettico abbia dimostrato un effetto significativo della emofiltrazione nella rimozione di citokine proinfiammatorie (Schetz e Coll,1995;a)
Le prime metodiche di emofiltrazione continua (Continuous Arterovenous Hemofiltration,CAVH) (fig.1) prevedevano l'utilizzo di due accessi vascolari (arterioso e venoso centrale) ed il flusso ematico attraverso il filtro era determinato dalla pressione arteriosa del paziente: la resa era di circa 400-600ml/h, e la capacità di clearance pari a circa 10 ml/min.
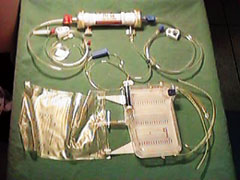 | Figura 1 - Circuito utilizzato per la Continuous Arterovenous Hemofiltration,CAVH |
Dalla metà degli anni '80, anche per il miglioramento dei materiali e della geometria dei filtri, si è passati all'incannulamento di un unico vaso venoso centrale con un catetere a doppio lume di grosso calibro per emodialisi o plasmaferesi (oppure, per una resa ancora maggiore, all'incannulamento di due vasi centrali ed all'utilizzo di due cateteri monolume di grosso calibro) ed all'uso di una pompa peristaltica che, aspirando e reimmettendo il sangue in circolo, consente elevati flussi attraverso il filtro: in questo modo si è potuto ottenere un aumento consistente della capacità depurativa (20 ml/min) grazie all' aumento dell'ultrafiltrato (da 1000 a 1500 ml/ora) (Continuous Venovenous Hemofiltration, CVVH) (fig.2,3). Un ulteriore aumento della capacità depurativa, con minori volumi di scambio e quindi con una più semplice gestione della metodica, è stato ottenuto con l'aggiunta della componente dialitica (Continuous Venovenous Hemodiafiltration, CVVHD), realizzata con il passaggio di una soluzione dialitica in controcorrente attraverso il filtro in ragione di 1 litro/ora: in tale modo si ottiene una clearance pari a 25 ml/min.(Bellomo,1994). Esistono tuttavia controversie sulla necessità di utilizzare la CVVHD per migliorare la resa depurativa (Barton e Hilton,1993).

| |
| Figura 2 - Continuous Venovenous Hemofiltration, CVVH | Figura 3 - Filtro utilizzato nella CVVH |
In caso di utilizzo di tecnica non dialitica, l'ultrafiltrato sarà identico al siero e la soluzione sostitutiva dovrà prevedere una composizione adeguata in sodio, calcio e potassio; in caso di utilizzo di dialisi devono invece essere previsti supplementi di fosfato.
Una delle maggiori difficoltà nelle terapie sostitutive protratte appare essere la gestione del bilancio fluidico, essendo gli obbiettivi del trattamento da una parte la sottrazione di liquidi in eccesso (edemi), dall'altro la depurazione. La resa giornaliera del filtro può variare da 20 a 30 litri /die: in tale caso occorre da una parte il controllo orario della quantità dell'ultrafiltrato, dall'altro la programmazione della quantità e della qualità del rimpiazzo volemico e la definizione dei valori delle pressioni di riempimento da ottenere o mantenere (Baudouin et Coll,1993). La realizzazione, quando necessario, di un bilancio negativo (che deve tenere presente tutte le perdite, compresa la diuresi se questa riprende) non deve superare i 100/200 ml/ora, pena la possibilità di importanti squilibri emodinamici e metabolici (non ultime le gravissime deidratazioni). A questo proposito, per evitare un aggravio del lavoro di assitenza e per ottenere un bilancio fluidico di estrema precisione, sono in corso di valutazione sistemi automatizzati, computerizzati o addirittura basati su un servo controllo computerizzato a circuito chiuso in cui la reinfusione viene regolata rispettivamente sul valore dell'ultrafiltrato, dell'ultrafilttrato e della eventuale diuresi, su ultrafiltrato, diuresi e variabili emodinamiche (pressioni di riempimento) (Bellomo,1994). Deve essere infine ricordata la possibilità di induzione di ipotermia (auspicabile in corso di ipertermia) specie nelle emofiltrazioni ad elevato flusso in pazienti paralizzati con curari: questo comporta, per il mantenimento dell'equilibrio termico, l'utilizzo di tecniche di riscaldamento del paziente o dei fluidi di sostituzione (Matamis et Coll, 1994). Un ruolo importante nel funzionamento e nella resa di queste metodiche di sostituzione continua è certamente giocato dal tipo di filtri .Le due conformazioni principali attualmente utilizzate per le membrane sono quella a fibre cave (hollow fiber) e quella a flussi paralleli (parallel plate) (Bellomo,1994): sebbene non vi siano studi in vivo, le membrane in poliacrilonitrile con configurazione che consenta flussi paralleli (parallel plate) appaiono essere quelli a resa migliore ed a maggiore biocompatibilità in vitro (Yohai,1992) .
Un problema rilevante nel paziente critico può essere legato alla necessità di mantenere una condizione di anticoagulazione per la resa ottimale dei filtri. Il farmaco di scelta appare essere l'eparina, somministrata prima del filtro: a seconda delle condizioni dei pazienti possono essere utilizzati dosaggi che vanno dalle 300 alle 700 UI/ora, con controllo del tempo di coagulazione (mantenuto tra 8 e 12 minuti) o dell'aPTT (mantenuto con una R di 1.5-2). Tali regimi hanno consentito una vita media del filtro superiore alle 24 ore. L'uso di anticoagulazione regionale (eparina (E) prima del filtro, solfato di protamina (P) dopo il filtro in rapporto E/P 100/1) è stato da alcuni utilizzato, ma richiede monitoraggio frequente ed offre sopravvivenza del filtro analoga alla somministrazione convenzionale di eparina (prima del filtro) (Bellomo et al,1993). La CVVH(D) realizzata con i filtri della ultima generazione (poliacrilonitrile, parallel plate membrane) nei pazienti a rischio emorragico (ipopiastrinemici, postoperati, con DIC) ha consentito ottima resa e sopravvivenza prolungata dei filtri anche senza anticoagulazione (Bellomo,1994).
Resta da definire invece il possibile
ruolo di eparine a basso peso molecolare, prostaciclina o inibitori
delle proteasi (gabesato mesilato, nafamostat mesilato) nella
anticoagulazione in corso di CVVH. Nuove prospettive sembrano
invece aperte dall'uso di filtri con eparina legata alle membrane
(Heparin - bonded membranes).
La somministrazione di farmaci e di nutrienti durante sostituzione continua
Antibiotici
Rispetto alle tecniche convenzionali di depurazione intermittente, l'utilizzo di tecniche di depurazione continua (CVVH) determina una importante modificazione degli schemi di somministrazione di antibiotici .
Esempi eclatanti vengono dall'uso di vancomicina, che, non eliminata con la emodialisi convenzionale, viene attivamente sottratta dal circolo con CVVH o CVVHD e può richiedere la somministrazione di 1gr/die anzichè di un grammo /settimana (Bellomo,1994), oppure dagli aminoglicosidi, la cui clearance può variare a seconda delle tecniche da 5 a 25 ml/min (Davies,1992;Bellomo,1994). La capacità di una sostanza di passare attaverso la membrana di un emofiltro è espressa dal sieving coefficient (S), determinato dal rapporto tra la concentrazione della sostanza nell'ultrafiltrato e nel plasma e variante da 0 per sostanze che non passano a 1 per sostanze che passano liberamente (Schetz et Coll,1995). In effetti il fattore a cui è principalmente legata la estrazione della sostanza, e quindi il suo profilo cinetico, in corso di sostituzione continua è il legame proteico; in presenza di dialisi convenzionale (meccanismo diffusivo) intervengono invece, oltre al legame proteico, il peso molecolare, la permeabilità di membrana, il flusso del dialisato (Bellomo, 1994; Schetz et Coll,1995). In corso di CVVH pertanto esiste la necessità di ricorrere ai dosaggi ematici dei vari antibiotici o chemioterapici dopo la somministrazione (picco), prima della successiva somministrazione (valle), nel periodo tra le due somministrazioni (dosaggi intermedi), per costruire una curva cinetica che consenta di personalizzare il dosaggio ed ottenere concentrazioni ematiche ottimal (Schetz et Coll,1995), ricordando che le variabili cinetiche nel paziente critico non consentono spesso sufficiente prevedibilità. Non appaiono invece modificati i livelli ematici di ormoni, catecolamine, calcioantagonisti, vasodilatatori ( Bellomo,1994;Schetz et Coll,1995)).
Si rimanda comunque per un inquadramento
completo dell'argomento ad un recentissimo articolo di Schetz
e Coll (1995).
Nutrienti
La possibilità di attuare una
corretta nutrizione sia per carico calorico che per apporto di
azoto è stata fino a pochi anni fa limitata nell'insufficiente
renale acuto da una parte dalla necessità di somministrare
elevati quantitativi di fluidi, dall'altra dalla impossibilità
di fornire aminoacidi: l'importanza della somministrazione di
aminoacidi in questi pazienti era tuttavia già stata evidenziata.
L'avvento delle tecniche di sostituzione extrarenale continua
ha consentito in pazienti gravemente catabolici e con insufficienza
renale oligoanurica da una parte il controllo della iperazotemia,
dall'altro il corretto apporto calorico e la supplementazione
ottimale di azoto. In uno studio recente (Bellomo,1991) è
stata dimostrata la possibilità di ottenere in pazienti
gravemente catabolici una positivizzazione del bilancio azotato
con un corretto carico calorico (25-30 kCal kg-1 die-1 ), supplementazione
di azoto in ragione di 250-300 mg kg-1 die-1. Il problema della
eventuale perdita di amonoacidi attraverso il filtro, valutata
in vari studi (Bellomo,1994) è risultata essere attorno
al 10% e pertanto trascurabile. L'apporto vitaminico deve essere
completo ed eventualmente supplementata la quantità di
folato e vitamina C. I pochi dati disponibili sugli oligoelementi
non depongono per perdite clinicamente rilevanti.
BIBLIOGRAFIA
1) JH Shaefer,F Jochimsen,K Wegsheider,,A Distler. Outcome prediction of acute renal failure in medical intensive care.Intensive Care Medicine,1991;17:19-24
2) HL Corwin,JL Bonventre . Acute renal failure in the Intensive care unit.Intensive Care Medicine,1988;14:10-16.
3) HH Rasmussen,LS Ibels. Acute renal failure: multivariate analysis of causes and risk factors.Am J Med,1982;73:211
4) RL Lins, M Coutenye, ME De Broe .Value of diagnostic investigations in acute renal failure.In JL Vincent Update in Intensive Care and Emergency Medicine 1988 : 668 . Springer Verlag.
5) RJ Anderson,RW Schrier Acute Renal failure.Cap 275 in Harrison's Principles of Internal Medicine.IX Ed.1988 McGraw Kogakusha
6) RS Muther Acute Renal failure : acute azotemia in the critically ill.Cap 123 ,1583 In Civetta ,Taylor,Kirby Eds Critical care 2° Ed.1992.Lippincott Co.
7) BL Rayner,PA Wilcox,MD Pascoe.Acute renal failure in community acquired bacteremia.Nephron,1990;54:32
8) Burton D Rose. Clinical physiology of acid base and electrolytes disorders. Cap 15 Meaning and applications of urine chemistries III Ed.McGraw Hill International .1989
9) RA Sherman,RP Eisinger.The use and misuse of urinary sodium and chloride measurements.JAMA,1982;247:3121
10) PE Stevens,SJ Gwyter,ME Hanson,JE Boultbee,WJ Kox,ME Phillips.Monitoraggio non invasivo nell'uomo delle caratteristiche del flusso enmatico renale durante IRA.Intensive Care Med,1990;16:139-144.
11) M Brezis,S Rosen,FH Epstein Acute renal failure.In The Kidney- IV Edition- Brenner e Rector Eds . Cap 24 .Saunders,1991
12) RW Van Olden,JJM Van Meyel,PGG Gerlag. Sensitivity of residual nephrons to high dose furosemide described by diuretic efficiency.Eur J Clin Pharmacol,1995;47:483-488
13) MJ Krasna,GE Scott,PM Scholtz,AJ
Spotniz,JW MacKanzie,F Penn.Postoperative enhancemenet of urinary
output in patients with acute renal failure using continuous furosemide
therapy.Chest,1986;89:294-295.
14) R Bellomo . Acute renal replacement therapy. Cap 9 in Current
Topics in Intensive Care,J Dobb Editor ,1994 ;1: 162-179.Saunders
15) (a) M Schetz,P Ferdinande,G Van Den Berghe,C Verwaest,P Lauwers.-Removal of proinflammatory cytokines with renal replacement therapy:sense or nonsense.Intensive Care Med,1995;21:169-176
16) D Matamis,M Tsagourias,K Koletsos,D Riggos,K Mavromatidis,K Sombolos,S Bursztein.Influence of continuous haemofiltration - related hypotermia on hemodynamic variables and gas exchange in septic patients.Intensive Care Med,1994;20:431-436
17) D Yohai, DW Butterly,SJ Schwab,D Quartes. Continuous arterovenous hemodialysis: effect of dialyzer geometry.Kidney International,1992;42:448 - 451
18) R Bellomo,H Teede,N Boyce .Anticoagulation regimens in acute continuous hemodiafiltration:a comparative study.Intensive Care Med,1993;19:329-332
19) SP Davies,BS Azadian,WJ Cox,EA Brown.Pharmacokinetics of ciprofloxacin and vancomycin in patients with acute renal failure treated with continuous hemodialysis.Nefrology,Dialysis,Transplantation,1992;7:848-854
20) IK Bartok,PJ Hilton, Veno venous hemofiltration in the Intensive Care Unit. Clinical Intensive Care,1993;4:16-22
21) SV Baudouin,J Wiggins,BF Keogh,CJ Morgan,TW Evans.Continuous veno-venous hemofiltration following cardiopulmonary bypass.Intensive Care Med,1993;19:290-293.
22) TJ Burke,RE Cronin,KL Duchin,LN Peterson,RW Schrier.Ischemia and tubular obstruction during acute renal failure in dogs: mannitol in protection .Am J Phys,1980;238:F305.
23) (b) M Schetz,P Ferdinande,G Van Den Berghe,C Verwaest,P Lauwers Pharmacokinetics of continuous renal replacement therapy.Intensive Care Med,1995;21:612-620.